Требования к содержанию и оформлению отчёта по практической работе
Теоретический материал
1. Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м3) и тяжелые (от 6000 кг/м3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
|
|
|
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
M – ne = Mn+
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Металлы взаимодействуют с неметаллами (обычно при нагревании):
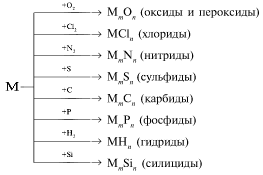
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
|
|
|

Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.

Более активные металлы вытесняют менее активные из растворов их солей.

Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
|
|
|
Вопросы для закрепления теоретического материала к практическому занятию
1. Перечислить общие физические свойства металлов.
2. Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
3. Какие способы получения металлов Вы знаете?
Задания для практического занятия:
1. Решить предложенные задачи.
2. Правильно оформить их в тетрадь для практических и контрольных работ.
3. Ответить на вопросы для контроля.
4. Отчитаться о выполненной работе преподавателю.
Задание 1
| Напишите уравнение реакции взаимодействия металла с кислотой | |
| Вариант 1 | Вариант 2 |
| алюминий + серная кислота | железо + соляная кислота |
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
ZnCl®Zn + 2HCl 2 + H2
В результате реакции выделяется газ (H2) водород.
Задание 2
| Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла | |
| Вариант 1 | Вариант 2 |
| алюминий + железный купорос | железо + медный купорос |
Образец решения задания № 2
|
|
|
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
Zn + CuSO4 ZnSO®4 ¯+ Cu
В результате реакции выделяется металлическая медь (красный осадок).
Вопросы для контроля
1. Перечислите основные химические свойства металлов?
2. Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
3. Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю по дисциплине ДУП 01.03.Основы естественных наук.
Источники:
1.https://5terka.com/node/11310
2.https://multiurok.ru/files/prakticheskoe-zaniatie-4-vzaimodeistvie-metallov-s.html
Теоретический материал
В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMnO4, в быту называемый марганцовкой.
Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона MnO4- .
Перманганаты являются солями марганцевой кислоты HMnO4, которая устойчива только в разбавленных растворах (до 20%).
В зависимости от среды перманганат калия может восстанавливаться до различных соединений.
При нагревании сухого перманганата калия до температуры выше 2000С он разлагается по схеме: KMnO4 → K2MnO4 + MnO2 + O2↑
Этой реакцией в лаборатории пользуются для получения кислорода.
Марганцовая кислота HMnO4 и соответствующие ей соли - перманганаты, например, KMnO4, имеют в растворах характерный фиолетовый цвет.
Перманганаты являются сильными окислителями, особенно в кислой среде. Продуктами восстановления перманганат-ионов могут быть ионы Mn2+ (бесцветный раствор в кислой среде), черно-бурый осадок MnO2 (в нейтральной или слабощелочной среде) или ионы MnO42- (зеленый раствор в сильнощелочной среде):
а) KMnO4 + H2SO4 + Na2SO3 → MnSO4 + Na2SO4 + K2SO4 + Н2О
б) KMnO4 + H2O + Na2SO3 → MnO2 + Na2SO4 + KOH
в) KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O
Требования к содержанию и оформлению отчёта по практической работе
Запишите в тетрадь лабораторно-практических занятий:
1. Название и цель работы.
2. Наименование и краткое описание опытов, наблюдения, химизм процесса (коэффициенты в уравнениях реакций расставьте методом электронного баланса)
3. Вывод к работе, в котором отразите, как изменяется окраска раствора при восстановлении перманганат-иона в различных средах.
4. Ответы к контрольным вопросам для самопроверки.
Контрольные вопросы для самопроверки
1. Какие реакции называются окислительно-восстановительными?
2. Какие вещества называются окислителями? восстановителями?
3. Какие из приведенных ниже веществ проявляют: а) только окислительные, б) только восстановительные, в) окислительные и восстановительные свойства: H2SO3, Zn, KI, КМnO4, NaNO2, K2Cr2O7, FeSO4, HNO3, H2S, Cl2, H2O, K2SO3, H2SO4?
Методика выполнения задания.
Опыт 1. Окислительные свойства перманганата калия. В три пробирки налейте по 5-6 капель раствора KMnO4.
Затем в первую пробирку прибавьте 3-4 капли раствора H2SO4, во вторую – ничего не приливаем, а в третью - 3-4 капли раствора NaOH.
После этого в каждую пробирку прибавьте сухую соль Na2SO3. Как изменяется окраска растворов?
Запишите уравнения реакций взаимодействия перманганата калия с сульфитом натрия в кислой, нейтральной и щелочной средах.
Расоставьте коэффициенты в уравнениях реакций методом электронного баланса, сделайте вывод об окислительных свойствах перманганата калия при различных значениях рН. Опыт 2. Разложение перманганата калия при нагревании (получение, собирание и распознавание кислорода).
· Соберите прибор, как показано на рисунке.
В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO·4 , у отверстия пробирки положите рыхлый комочек ваты.
Закройте пробирку пробкой с газоотводной трубкой.·
Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.·
Наличие кислорода в сосуде проверьте тлеющей лучинкой,·
для этого поднесите её к отверстию стакана. Что наблюдаете?
· Опишите физические свойства кислорода, наблюдаемые при проведении опыта.
· Запишите уравнение соответствующей реакции, Расставьте коэффициенты методом электронного баланса. Отметьте, окислителем или восстановителем является перманганат калия в данной реакции.
· Источники:
· 1.https://5terka.com/node/11310
· 2. https://multiurok.ru/files/laboratornaia-rabota-okislitelnye-svoistva-permang.html
Дата добавления: 2020-11-29; просмотров: 68; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
