Основные показатели химико – технологического процесса.
К основным показателям процесса относят:
-степень превращения исходных реагентов,
-выход продукта,
- скорость превращения,
- избирательность (селективность) процесса,
- расходные коэффициенты.
Cтепень превращения
Качество процесса с точки зрения полноты использования сырья оценивают с помощью степени превращения сырья (конверсии).
Степень превращения – это отношение количества (массы, объема) одного из реагентов, вступившего в реакцию, к начальному количеству (массе, объему) этого реагента. Например, для реакции:
аА + бВ = dD; (1)
если количество вещества выражено массой, то степень превращения вещества Х будет выражена по формуле:
- для вещества А: ХА= ( m А,0 - m А )/ m А,0 , (2)
где m А,0 , - масса реагента А в начале процесса;
m А - масса реагента А в конце процесса;
- для вещества В: ХВ= ( m B , 0 - m В )/ m B , 0 (3)
где m B , 0 - масса реагента B в начале процесса;
m В - масса реагента А в конце процесса;
если количество вещества выражено числом молей n, то степень превращения вещества Х будет выражена по формуле:
- для вещества А: ХА= ( n А,0 - n А )/ n А,0 , (4)
где n А,0 , - масса реагента А в начале процесса;
|
|
|
n А - масса реагента А в конце процесса;
- для вещества В: ХВ= ( n B , 0 - n В )/ n B , 0 (5)
где n B , 0 - масса реагента B в начале процесса;
n В - масса реагента B в конце процесса;
если количество вещества выражено объемом реагентов v, то степень превращения вещества Х будет выражена по формуле:
- для вещества А: ХА= ( v А,0 - v А )/ v А,0 , (6)
где v А,0 , - масса реагента А в начале процесса;
v А - масса реагента А в конце процесса;
- для вещества В: ХВ= ( v B , 0 - v В )/ v B , 0 (7)
где v B , 0 - объем реагента B в начале процесса;
v В - объем реагента B в конце процесса;
Если реагенты А и В взяты в стехиометрическом соотношении, то ХА = ХВ .
Степень превращения реагента, взятого с избытком от стехиометрического соотношения, всегда будет ниже, чем для реагента, поступающего в недостатке.
Для процессов межфазной массопередачи (испарение, конденсация, абсорбция, десорбция и др.) степень превращения называют степенью межфазного перехода. Например, степенью абсорбции, степенью десорбции, степенью конденсации и др.
Для сложных (параллельных, последовательных и др.) реакций наряду со степенью превращения исходных веществ используют понятие «выход продуктов».
|
|
|
Выход продукта Ф – это отношение фактически полученного продукта n ф (или m ф ) к его максимальному количеству n макс (или m макс ), рассчитанному по стехиометрическому уравнению реакции при степени превращения исходных реагентов, равной единице:
Фф= n ф / n макс = m ф / m макс (8)
Если в реакции участвуют два или более веществ, например, А+В → D, то различают выход целевого продукта D по исходному веществу А (ФD(А)) и по веществу В(ФD(В)). Если исходные вещества А и В содержатся не в стехиометрическом соотношении, то ФD(А) ≠ ФD(В)).
Для простых реакций (т.е. отсутствие параллельных и последовательных превращений) выход продукта численно равен степени превращения исходных веществ.
Для простых необратимых реакций максимальных фактический выход
Фф макс. = 1.
Для обратимых реакций исходное вещество превращается в продукт не полностью, для них справедливо выражение: Фф макс. < 1.
Для этого случая если вместо n ф подставить количество продукта, полученное в условиях равновесия, n *, то этот выход называют равновесным Ф*: Фф макс= n */ n макс = Ф*; (9)
|
|
|
Для характеристики степени приближения обратимого процесса к равновесию используют понятие выхода от теоретического или выхода равновесного. Это отношение фактически полученного продукта n ф к количеству его, которое получилось бы, если процесс пришел бы в состояние равновесия n *: Ф τ = n ф / n *= Ф ф / Ф*; (10)
Выход продукта выражают в долях единицы или в процентах. Этот показатель отражает степень совершенства технологического процесса, затраты сырья на единицу продукта и экономические показатели производства конкретного продукта.
Скорость ХТП .Чтобы определить время, необходимое для достижения
необходимого выхода продукта или необходимой степени превращения исходного реагента, необходимо знать скорость химико-технологического процесса. Она определяет интенсивность протекания процессов.
Скорость химико-технологического процесса выражается изменением количества компонента, прореагировавшего или образовавшегося в результате химической реакции в единицу времени в единице реакционного объема  (для гомогенных химико-технологических процессов) или на единице поверхности S раздела фаз (для гетерогенных химико-технологических процессов).
(для гомогенных химико-технологических процессов) или на единице поверхности S раздела фаз (для гетерогенных химико-технологических процессов).
|
|
|
Если при протекании процесса не происходит обмен веществом с окружающей средой, средняя скорость расходования исходного вещества или образования продукта за интервал времени Δ τ=τ2 – τ1 в общем случае равна: Ū = ( n 2 – n 1 )/[  ср(τ2 – τ1 )] = Δ n / (
ср(τ2 – τ1 )] = Δ n / (  ср ·Δ τ), где : (11)
ср ·Δ τ), где : (11)
n 2 , n 1 – число молей вещества в моменты времени τ2 и τ1;
 ср - средний объем реагирующей смеси.
ср - средний объем реагирующей смеси.
Средняя скорость соответствует интенсивности протекания процесса.
При Δ τ=0 имеем дело с мгновенной или истинной скоростью, соответствующую конкретному моменту времени.
Мгновенная скорость ХТП равна: U = lim  =±
=± 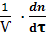 (12)
(12)
Данным уравнением можно пользоваться при соблюдении двух условий:
а) реакционный объем остается постоянным;
б) объем можно считать закрытым.
Закрытым или замкнутым объемом считают такие условия, когда реагирующая система не обменивается веществом с окружающей средой. Это относится к процессам, протекающим в реакторах периодического действия.
Если скорость опроеделяют по образующемуся продукту реакции, то выражение (12) используют со знаком плюс, если по исходному веществу, то со знаком минус.
Для ХТП, протекающих при постоянном объеме, с учетом того, что
ni /  т.е. равно, концентрации вещества, то при постоянном объеме имеем: U = ±
т.е. равно, концентрации вещества, то при постоянном объеме имеем: U = ±  , (13)
, (13)
где С i концентрация i - того вещества.
Для гетерогенных ХТП, когда реакция протекает на границе раздела фаз, скорость определяют через единицу межфазной поверхности S :
U = ±  ;
;
Для гетерогенно – каталитических процессов скорость реакции выражают в расчете на единицу массы катализатора mk : U = ±  ; (14)
; (14)
Скорость ХТП имеет сложную зависимость от скоростей физических и химических процессов, которые в свою очередь определяются гидродинамическими параметрами движения реагентов, условиями перемешивания, диффузии, концентрациями, давлением, температурой и другими факторами.
В общем виде формула для расчета скорости процесса имеет вид:
U = 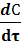 = К
= К  К – коэффициент скорости процесса;
К – коэффициент скорости процесса;
 - движущая сила процесса.
- движущая сила процесса.
Коэффициент скорости процесса является функцией констант скоростей прямой, обратной и побочных реакций, коэффициентов диффузии исходных реагентов к поверхности раздела фаз и продуктов реакций от поверхности раздела.
Движущая сила процесса является сложной функцией текущих и равновесных концентраций реагирующих веществ.
Избирательность.
Чаще всего наряду с основной реакцией образования целевого продукта протекают побочные параллельные или последовательные реакции с образованием нежелательных или менее ценных продуктов. Поэтому избирательность или селективность является одной из важнейших характеристик ХТП. Различают суммарную (интегральную) избирательность и мгновенную (дифференциальную) избирательность.
Суммарная избирательность 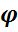 сум определяется как отношение количества исходного вещества, превратившегося в целевой продукт, к общему количеству прореагировавшего исходного вещества.
сум определяется как отношение количества исходного вещества, превратившегося в целевой продукт, к общему количеству прореагировавшего исходного вещества.
Например. В ХТП имеют место параллельные реакции:
аА → bB и аА → dD , целевым продуктом является вещество В.
Суммарная избирательность выражается  сум В в следующем виде:
сум В в следующем виде:
 сум В = (a/ b)·nB / ( n A, 0 - n A ) ;
сум В = (a/ b)·nB / ( n A, 0 - n A ) ;
Из предыдущего материала по формуле (4)
степень превращения вещества Х будет выражена:
- для вещества А: ХА= ( n А,0 - n А )/ n А,0 , (4)
где n А,0 , - масса реагента А в начале процесса;
n А - масса реагента А в конце процесса;
Выход продукта В : Ф B ( A ) = ( a / b )· nB / n A , 0 ;
Можно установить связь между степенью превращения ХА , выходом продукта Ф B ( A ) и суммарной избирательностью  сум В ;
сум В ;
ХА·  сум В = Ф B ( A ) ;
сум В = Ф B ( A ) ;
Втехнологии существует также такое понятие как мгновенная избирательность.Мгновенная избирательность измеряется отношением скорости образования целевого продукта к скорости потребления исходного реагента на образование всех продуктов реакции.Мгновенная избирательностьравна отношению скорости основной реакции к общей скорости процесса, выраженной через количества исходного реагента:
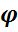 мгн В = U В / U А Иногда мгновенную избирательность выражают отношением скоростей образования целевого и побочного продуктов:
мгн В = U В / U А Иногда мгновенную избирательность выражают отношением скоростей образования целевого и побочного продуктов:
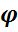 мгн В = U В / U D ;
мгн В = U В / U D ;
Расходные коэффициенты характеризуют затраты сырья на производство.
Расходный коэффициент – это отношение количества сырья, затраченного на проведение ХТП, к количеству полученного целевого продукта.
Теоретический расходный коэффициент рассчитывают по стехиометрическому уравнению основной реакции с учетом содержания исходного реагента в сырье. Например, коэффициент для реакции aA → bB теоретический расходный 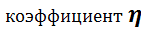 τ для получения продукта В определяется по следующей формуле:
τ для получения продукта В определяется по следующей формуле:  τ = aMA /( bMBωA , C ), где
τ = aMA /( bMBωA , C ), где
MA – молекулярная масса реагента А;
MB – молекулярная масса продукта В;
ωA,¢- массовая доля компонента А в сырье, %
Практический расходный коэффициент учитывает степень превращения исходного реагента ХА , выход продукта Ф B ( A ) , избирательность 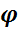 сум,В :
сум,В : 
 n =
n =  τ/( ХА·
τ/( ХА·  сум В) =
сум В) =  τ/ Ф B ( A ) ;
τ/ Ф B ( A ) ;
Практический расходный коэффициент всегда выше теоретического. Одной из главных задач технологов является стремление уменьшить отношение
 n /
n /  τ , без увеличения себестоимости продукта. Уменьшение отношения практического расходного коэффициента к теоретическому происходит при повышении степени превращения, повышении избирательности и как следствие – выхода продукта.
τ , без увеличения себестоимости продукта. Уменьшение отношения практического расходного коэффициента к теоретическому происходит при повышении степени превращения, повышении избирательности и как следствие – выхода продукта.
Материальный баланс . Основой технологических расчетов являются расчеты материальных потоков ХТП. Самым распространенным видом расчетов является составление материальных балансов. Материальные балансы составляют на основе закона сохранения массы вещества с учетом стехиометрических соотношений. Материальный баланс означает, что общая масса всех входящих в аппарат материалов (приход) равна общей массе выходящих веществ (расход):
Р Р
Σ mi вх = Σ mi вых
i =1 i =1
Число реагентов в зависимости от условий протекания процесса может изменяться от 1 до Р . Материальный баланс ХТП составляют с учетом параллельных и побочных реакций.Расчет материального баланса выполняют в единицах массы (кг, т) или в единицах количества вещества (моль, кмоль), а также в процентах. На производстве составляют материальные балансы для реактора, установки, цеха, завода.
Различают балансы на единицу времени и единицу продукции.
Материальный баланс на единицу времени составляют для непрерывных процессов для расчета размеров аппаратов, диаметров трубопроводов, определения концентраций и количества выходной продукции и реагирующих компонентов, для получения экономических показателей.
Материальный баланс на единицу продукции составляют как для непрерывных так и для периодических процессов целью определения теоретических и практических расходных коэффициентов.
Материальный баланс представляют в виде таблиц, которые включают приходную и расходную части.
Порядок составления материального баланса на примере процесса обжига серного колчедана. Серный колчедан, полезной составляющей частью которого является двусернистое железо FeS2, окисляетсяв печи обжига кислородом воздуха по уравнению
4 FeS2 + 11 О 2 = 2Fe2O3 + 8 SO 2 + Q;
Для составления материального баланса учитывается количество всех веществ, подаваемых в печь обжига (статьи прихода) и выходящих из нее (статьи расхода). Статьи прихода: колчедан, воздух, присутствующая в них влага. Статьи расхода- огарок, получающийся по реакции, содержащий в основном Fe2O3, печной газ- газовая смесь, состоящая из SO 2 , SO 3 , О2, N 2 , паров воды. На основе данных составлен материальный баланс , все величины рассчитаны на 1 час работы печи, т.е. баланс составлен на единицу времени.
Материальный баланс печи обжига колчедана
| Приход | Количество кг/ч | Расход | Количество кг/ч |
| Колчедан Влага с колчеданом Воздух сухой Влага с воздухом | 18020 560 70250 510 | Огарок Обжиговый газ: SO 2 SO 3 О2 N 2 Н2О | 13560 13780 940 6360 53700 1060 |
| В с е г о | 89400 | 89400 |
Для расчета этих величин необходимо знать стехиометрическое уравнение, описывающее реакцию, производительность установки, состав перерабатываемых продуктов, полноту использования исходного сырья.
Тепловой баланс.
По данным материального баланса с учетом тепловых эффектов реакций и физических превращений, подвода теплоты извне или отвода ее составляют тепловой баланс, который позволяет определить потребность в топливе, температуру в зоне реакции, площадь теплообменных поверхностей и расход энергоносителей.
Основой теплового баланса является закон сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна. Для расчета затрат энергии на исследуемое производство может быть составлен энергетический баланс , учитывающий расходы электроэнергии, технологического пара и воды на получение продукта.
Общий вид теплового баланса:
Q вх + Q'ф+ Q'р+ Qнагр. = Q вых + Q"ф+ Q"р+ Q охл , где
Q вх – количество теплоты, вносимое в аппарат,
Q вых – количество теплоты, выносимое из него жидкими или газообразными веществами,
Q'ф и Q"ф – тепловой эффект физических процессов, происходящих с выделением (') и поглощением (") теплоты,
Q'р и Q"р – теплота экзотермических (') и эндотермических (") химических реакций,
Qнагр.- кол-во теплоты, подводимое в аппарат извне для нагрева реакционной смеси,
Q охл – кол-во теплоты, отводимое через холодильники для поддержания заданного температурного режима.
На практике чаще всего тепловой баланс составляют для аппаратов для определения технологических параметров и условий для обеспечения заданного температурного режима.
Величины Q вх и Q вых рассчитывают по уравнениям:
Рвх _
Q вх = Σ mi · С i ·t вх , i ;
i=1
Рвых _
Q вых = Σ mi · С i ·t вых , i ;
i =1
где: mi – масса (объем, количество) исходных реагентов и продуктов реакции, прошедших через аппарат в единицу времени кг/с (м3/с, кмоль/с);
_
С i – средняя удельная теплоемкость компонентов, кДж/(кг·К) [кДж/(м3·К), кДж/(кмоль·К);
t вх, i ; t вых, i – температура входного и выходного потоков, 0К;
Рвх, Рвых - число компонентов, участвующих в процессе.
Теплоты фазовых переходов реагентов в ходе процесса Q'ф и Q"ф, которые в зависимости от знака теплового эффекта фазового перехода учитываютс в приходной (кристаллизация, сублимация, конденсация) или расходной (испарение, плавление) частях баланса, рассчитывают по уравнению:
n
Q вх = Σ m ф , i · q ф , i ,
i =1
где: m ф , i – масса (объем, количество i –того реагента, участвующего в фазовом переходе (кг/с, кмоль/с);
q ф, i – тепловой эффект фазового перехода i–того компонента, кДж/кг (кДж/м3, кДж/кмоль);
Теплоту реакций определяют по уравнению:
n
Q р = Σ m р , i · q р , i ,
i =1
где: m р , i – масса (объем, количество) i –того реагента, вступившего в реакцию или образовавшегося в ходе реакции, кг/с (м3/с, кмоль/с);
q р – тепловой эффект реакции, кДж/кг (кДж/м3, кДж/кмоль);
Qнагр. и Q охл определяют по уравнениютеплопередачи, согласно которому количество переданной теплоты Q = К τ · F · ΔT ,
К τ- коэффициент теплопередачи, Вт/м2·К);
F – площадь поверхности теплообмена, м2;
ΔT – разность температур теплоносителя и реакционной зоны (движущая сила процесса теплопередачи).
Из уравнения теплового баланса можно рассчитать любой из параметров при известных остальных. Например, Т вх, F .
Дата добавления: 2019-11-25; просмотров: 1803; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
