Определение содержания фенола
Метод основан на присоединении брома к молекуле фенола в кислой среде:
C6H5OH + 3Br2 = C6H2Br3OH + 3HBr
Избыток непрореагировавшего брома восстанавливают иодидом калия с образованием иода, который затем оттитровывают тиосульфатом натрия:
Br2 + 2KJ = J2 + 2KBr
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6
Реактивы
Бромат-бромидная смесь KBrO3 +KBr, 0,05 н;
Кислота хлористоводородная, HCl, разбавление 1:1;
Тиосульфат натрия, Na2S2O3, 0,05 н раствор;
Калий иодистый, KI, кристаллический;
Крахмал, 1%-ный раствор.
Ход определения
Полученный в препараторской в мерной колбе исследуемый раствор доводят до метки дистиллированной водой и тщательно перемешивают. В коническую колбу для титрования переносят аликвотную часть раствора, добавляют 10 мл раствора соляной кислоты и постепенно приливают 25 мл бромат-бромидной смеси, закрывают пробкой и осторожно перемешивают в течение 10 мин до завершения реакции присоединения.
Затем обмывают стенки колбы дистиллированной водой из промывалки и добавляют 2 г иодида калия (2/3 пробирки). Выделившийся иод оттитровывают стандартным раствором тиосульфата натрия, добавляя перед концом титрования 5-6 капель крахмала. Точку эквивалентности определяют по обесцвечиванию раствора. Опыт повторяют 3-5 раз.
Расчетная часть
Содержание фенола определяют по формуле:
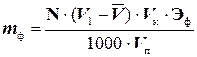 (г),
(г),
где: N - нормальность тиосульфата натрия;
V1 - объем раствора бромат-бромидной смеси, равный 25 мл;
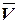 - средний объем тиосульфата натрия, пошедший на титрование, мл;
- средний объем тиосульфата натрия, пошедший на титрование, мл;
|
|
|
Эф - эквивалентная масса фенола, равная молекулярной массе, деленной на 6, Эф = 15,68;
Vк, Vп - объем соответственно мерной колбы и мерной пипетки, мл.
Лабораторная работа № 8
Комплексонометрическое титрование
Комплексонометрия или комплексонометрическое титрование ‑ метод титриметрического анализа, основанный на использовании реакций комплексообразования между определяемым компонентом анализируемого раствора и титрантом.
Это метод анализа, основан на использовании реакций ионов металлов с комплексонами, сопровождающихся образованием устойчивых малодиссоциированных растворимых в воде внутрикомплексных (хелатных) солей.
Одним из наиболее широко применяемых комплексонов является двунатриевая соль этилендиаминтетрауксусной кислоты (Nа-ЭДТА или трилон Б, сокращенно Na2H2Y).
| HOOCCH2 CH2COOH ½ ½ N— CH2 — CH2—N ½ ½ NaOOCCH2 CH2COONa |
При титровании ЭДТА солей металлов протекают следующие реакции в заключительной стадии определения:
|
|
|
Na2H2Y ⇄ 2Na+ + H2Y2–
Me2+(Ca2+) + H2Y2– ® MeY2– + 2H+
Me3+(In3+) + H2Y2– ® MeY‑ + 2H+
Me4+(Th4+) + H2Y2– ® MeY + 2H+
Согласно приведенным уравнениям, 1 моль реагирующих с Nа-ЭДТА катионов, независимо от их степени окисления, связывает 1 моль Nа-ЭДТА.
Титрование ЭДТА проводится при строго определенных условиях, из которых наибольшее значение имеет рН титруемого раствора. В сильнокислых растворах при рН<3 образуются неустойчивые комплексные соединения. Образованию устойчивых комплексных соединений способствует повышение значения рН. Однако в сильнощелочных растворах с рН>10 наблюдается образование комплексных оксосоединений или осадков гидроокисей определяемых катионов.
В качестве индикаторов (металл-индикаторов) используются органические красители, образующие с катионами сильно окрашенные комплексные соединения, менее стойкие.
Дата добавления: 2019-09-13; просмотров: 372; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
