Моляльная концентрация. Моляльность раствора (моль/кг).
Тема «Способы выражения концентрации растворов»
Формулы, которые пригодятся:
ρ (плотность раствора) = 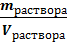
n (количество растворенного вещества) = 
1. Массовая доля w ( % )
Массовая доля растворённого вещества w - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w = 
Массовую долю растворённого вещества w обычно выражают в долях единицы или в процентах.
Например, 0,06 или 6% раствор CaCl2 в воде означает, что
6 граммов хлорида кальция содержится в 100 граммах раствора и, соответственно, в 94 граммах воды.
Пример 1: Сколько грамм сульфата натрия и воды нужно для приготовления 300г 5% раствора?
Дано:
m раствора (Na2SO4) = 300г
w раствора (Na2SO4) = 5%
Найти:
m(Na2SO4) - ? m(H2O) - ?
Решение:
w =  =
= 
Отсюда,
m ( Na 2 SO 4 ) = w × m раствора ( Na 2 SO 4 ) = 0,05 × 300 = 15 г
m(H2O) = m (раствора) – m раств.вещ-ва ( Na 2 SO 4 ) = 300 г - 15 г = 285 г.
Ответ: Для приготовления 300 г 5% раствора сульфата натрия надо взять 15г Na2SO4 и 285 г воды.
Молярная концентрация. Молярность (моль/л).
Молярная концентрация раствора ( 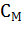 или M, моль/л) показывает, какое количество растворенного вещества содержится в 1 литре раствора,
или M, моль/л) показывает, какое количество растворенного вещества содержится в 1 литре раствора,
т.е. представляет собой отношение количества растворенного вещества к объему раствора:
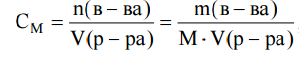
где m(в-ва) – масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль;
|
|
|
V(р-ра) – объем раствора, л.
Например, запись 0,1М раствор KCl означает, что 0,1 моль хлорида калия содержится в 1 л раствора хлорида калия.
Пример 2: Какую массу хромата калия K2CrO4 нужно взять для приготовления 1л 0,1 М раствора?
Решение :
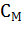 = n ( K 2 CrO 4 ) / V (р-ра) = m ( K 2 CrO 4 ) / M ( K 2 CrO 4 ) × V (р-ра)
= n ( K 2 CrO 4 ) / V (р-ра) = m ( K 2 CrO 4 ) / M ( K 2 CrO 4 ) × V (р-ра)
Отсюда, m ( K 2 CrO 4 ) = 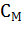 × M(K2CrO4) × V(р-ра) = 0,1 × 194 × 1 = 19,4 г
× M(K2CrO4) × V(р-ра) = 0,1 × 194 × 1 = 19,4 г
Нормальная концентрация. Молярная концентрация эквивалента вещества. Нормальность раствора (моль/л, гэкв/л).
( 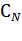 или N, н., моль/л, гэкв/л) показывает, какое количество эквивалентов растворенного вещества содержится в 1 л раствора (моль/л), и равна, таким образом, отношению количества эквивалентов вещества nэкв(в-ва) к объему раствора V(р-ра):
или N, н., моль/л, гэкв/л) показывает, какое количество эквивалентов растворенного вещества содержится в 1 л раствора (моль/л), и равна, таким образом, отношению количества эквивалентов вещества nэкв(в-ва) к объему раствора V(р-ра):

где m(в-ва) – масса растворенного вещества, г;
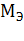 (в-ва) – молярная масса эквивалента растворенного вещества, г/моль.
(в-ва) – молярная масса эквивалента растворенного вещества, г/моль.
Например, 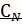 (СuCl2) = 0,01н. означает, что в 1 л раствора хлорида меди (II) содержится 0,01 эквивалентных масс этой соли.
(СuCl2) = 0,01н. означает, что в 1 л раствора хлорида меди (II) содержится 0,01 эквивалентных масс этой соли.
Грамм-эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
|
|
|
Эоснования = М основания /число замещаемых в реакции гидроксильных групп
Экислоты = М кислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / число атомов металла×валентность металла
Эоксида = М оксида /число атомов элемента×валентность элемента
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 6 = 57 г
Пример 3: Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 ( r = 1,615 г/мл).
Решение:
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70%-ный раствор H2SO4 означает, что 70 г H2SO4 содержится в 100 г раствора.
Соответственно, объем 100 г раствора равен:
V (р-ра H2SO4) = 100 / 1,615 = 61,92 мл
Следовательно,
в 1 л раствора содержится 70·1000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна:
СМ = 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Моляльная концентрация. Моляльность раствора (моль/кг).
(Cm или m, моль/кг) показывает число молей растворенного вещества в 1 кг (или 1000 г) растворителя:
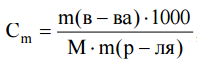
где Сm – моляльная концентрация, моль/кг р-ля;
|
|
|
m(в-ва) – масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль;
m(р-ля) – масса растворителя, г.
Например, запись Сm(HCl) = 2,0 моль/кг (водный раствор) обозначает, что 2 моль хлороводорода содержится в 1 кг (1000 г) растворителя, в данном случае, воды.
Пример 4: Вычислите моляльную концентрацию 12% раствора сульфата железа ( II ), если плотность раствора равна 1,122 г/мл.
Решение:
12% раствор FeSO4 означает, что 12 г FeSO4 содержится в 100 г раствора и (100-12=88) г растворителя.
n(FeSO4) = m(FeSO4) / M(FeSO4) = 12/152 = 0.079 моль, соответственно,
0.079 моль FeSO4 содержится в 88 г растворителя
Х моль FeSO4 содержится в 1000 г растворителя
=> Сm = 1000×0,079/88 = 0,897 моль/кг
Задачи для решения
391. Найти массовую долю глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы.
392. Сколько граммов Na2SO3 потребуется для приготовления 5л 8%-ного (по массе) раствора (ρ=1,075 г/мл)?
393. 1 мл 25%-ного (по массе) раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
394. Из 400 г 50%-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
396. Сколько граммов 30%-ного (по массе) раствора NaCl нужно добавить к 300 г воды, чтобы получить 10%-ный раствор соли?
|
|
|
397. В какой массе воды надо растворить 67,2 л HCl (объем измерен при нормальных условиях), чтобы получить 9%-ный (по массе) раствор HCl?
398. Какую массу 20%-ного (по массе) раствора KOH надо добавить к 1 кг 50%-ного (по массе) раствора, чтобы получить 25%-ный раствор?
399. Определить массовую долю вещества в растворе, полученном смешением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества.
400. Из 400 г 20%-ного (по массе) раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
401. Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора H2SO4 (ρ=1,14 г/мл), чтобы получить 5%-ный раствор?
402. К 500 мл 32%-ной (по массе) HNO3 (ρ=1,20 г/мл) прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
403. До какого объема надо разбавить 500 мл 20%-ного (по массе) раствора NaCl (ρ=1,152 г/мл), чтобы получить 4,5%-ный раствор (ρ=1,029 г/мл)?
404. Найти массовую долю азотной кислоты в растворе, в 1 л которого содержится 224 г HNO3 (ρ=1,12 г/мл).
405. Плотность 26%-ного (по массе) раствора KOH равна 1,24 г/мл. Сколько молей KOH находится в 5 л раствора?
406. Для приготовления 5%-ного (по массе) раствора MgSO4 взято 400 г MgSO4∙7H2O. Найти массу полученного раствора.
407. Сколько молей MgSO4∙7H2O надо прибавить к 100 молям воды, чтобы получить 10%-ный (по массе) раствор MgSO4?
411. Сколько граммов 2%-ного (по массе) раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35 г осадка AgCl?
412. Сколько литров NH3 (объем измерен при нормальных условиях) следует растворить в 200 г 10%-ного (по массе) раствора NH4OH, чтобы получить 15%-ный раствор NH4OH?
413. Сколько граммов SO3 надо растворить в 400 г H2O, чтобы получить 15%-ный (по массе) раствор H2SO4?
414. Найти массу NaNO3, необходимую для приготовления 300 мл 0,2 М раствора.
415. Сколько граммов Na2CO3 содержится в 500 мл 0,25 н. раствора?
416. В каком объеме 0,1 н. раствора содержится 8 г CuSO4?
417. Для нейтрализации 30 мл 0,1 н. раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
418. Найти молярность 36,2%-ного (по массе) раствора HCl, плотность которого 1,18 г/мл.
419. В каком объеме 1 М раствора и в каком объеме 1 н. раствора содержится 114 г Al2(SO4)3?
420. Растворимость хлорида кадмия при 20ºC равна 114,1 г в 100 г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
421. Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (ρ=1,84 г/мл) нужно взять для приготовления 1 л 0,25 н. раствора? Решение
422. Сколько миллилитров 0,5 М раствора H2SO4 можно приготовить из 15 мл 2,5 М раствора?
423. Какой объем 0,1 М раствора H3PO4 можно приготовить из 75 мл 0,75 н. раствора?
424. Какой объем 6,0 М раствора HCl нужно взять для приготовления 25 мл 2,5 М раствора HCl?
425. Плотность 40%-ного (по массе) раствора HNO3 равна 1,25 г/мл. Рассчитать молярность и моляльность этого раствора.
426. Вычислить массовую долю гидроксида натрия в 9,28 н. растворе NaOH (ρ=1,310 г/мл).
428. В 1 кг воды растворено 666 г KOH; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю KOH; б) молярность; в) моляльность.
429. Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
430. Плотность 9%-ного (по массе) раствора сахарозы C12H22O11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
431. Найти массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моля NaCl на 1000 г H2O, если имеется 10 г NaCl?
432. Какой объем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5 н. раствора?
433. Какой объем 0,05 н. раствора можно получить из 100 мл 1 н. раствора?
434. Какой объем 2 М раствора Na2CO3 надо взять для приготовления 1 л 0,25 н. раствора?
435. Сколько миллилитров концентрированной соляной кислоты (ρ=1,19 г/мл), содержащей 38% (масс.) HCl, нужно взять для приготовления 1 л 2 н. раствора?
436. К 100 мл 96%-ной (по массе) H2SO4 (плотность 1,84 г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Ответ: 1 моль;
Дата добавления: 2019-07-15; просмотров: 8282; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
