Література для підготовки теоретичного матеріалу
Опрацювати розділ 11 підручника [6] та 4 і 5.10 посібника [3].
План вивчення розділу
1 Типові окисники, відновники та речовини, що виявляють окисно-відновну двоїстість.
2 Типи окисно-відновних реакцій.
3 Загальні поняття електрохімії.
4 Хімічні джерела електричного струму. Гальванічні елементи.
5 Електроліз: правила розрядки на електродах, застосування. Закони Фарадея.
6 Корозія металів: визначення, види, механізм.
7 Методи захисту від корозії.
8 Приклади розв’язання типових задач і виконання завдань.
9 Завдання для самоперевірки.
Приклади розв’язання типових задач і виконання
Завдань
Приклад 1Визначте ступені окиснення елементів у таких сполуках: а)  ;б)
;б)  ;в)
;в)  ;г)
;г)  ;д)
;д)  .
.
Розв’язання: а) за деяким винятком у більшості складних сполук ступінь окиснення атомів Оксигену 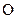 дорівнює -2. У молекулі
дорівнює -2. У молекулі  сумарне значення ступеня окиснення двох атомів
сумарне значення ступеня окиснення двох атомів 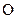 становить -4. З урахуванням електронейтральності речовини (алгебраїчна сума ступенів окиснення всіх атомів дорівнює нулю) зрозуміло, що ступінь окиснення атома Сульфуру повинен бути таким самим за абсолютною величиною (4), але протилежним за знаком, тобто дорівнювати +4:
становить -4. З урахуванням електронейтральності речовини (алгебраїчна сума ступенів окиснення всіх атомів дорівнює нулю) зрозуміло, що ступінь окиснення атома Сульфуру повинен бути таким самим за абсолютною величиною (4), але протилежним за знаком, тобто дорівнювати +4:


б) ступені окиснення атомів 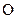 і
і  дорівнюють відповідно: –2 і +1. Оскільки у сполуці
дорівнюють відповідно: –2 і +1. Оскільки у сполуці  сумарне значення ступенів окиснення чотирьох атомів Оксигену становить –8, а двох атомів Калію – +2, ступінь окиснення атома Сульфуру дорівнює +6:
сумарне значення ступенів окиснення чотирьох атомів Оксигену становить –8, а двох атомів Калію – +2, ступінь окиснення атома Сульфуру дорівнює +6:
|
|
|

в) як і в попередньому прикладі, ступені окиснення атомів 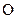 і
і  у складній сполуці
у складній сполуці  становлять відповідно: –2 і +1. Застосуємо розрахунковий метод обчислення, позначивши ступені окиснення атома Хрому через х. Запишемо суму ступенів окиснення атомів всіх елементів у молекулі:
становлять відповідно: –2 і +1. Застосуємо розрахунковий метод обчислення, позначивши ступені окиснення атома Хрому через х. Запишемо суму ступенів окиснення атомів всіх елементів у молекулі:
2 (+1) + 2х + 7 (–2) = 0,
звідки 2х = +12, а х = +6,
тобто ступінь окиснення одного атому Хрому +6.

г) у складних сполуках (за винятком гідридів активних металів) атоми Гідрогену  виявлять ступінь окиснення +1. На відміну від розглянутих випадків щодо нейтральних молекул у йоні сума ступенів окиснення всіх атомів дорівнює не нулю, а заряду йона. Для йона амонію
виявлять ступінь окиснення +1. На відміну від розглянутих випадків щодо нейтральних молекул у йоні сума ступенів окиснення всіх атомів дорівнює не нулю, а заряду йона. Для йона амонію  :
:
4 (+1) + х = +1, звідки х = –3.
Отже, ступінь окиснення Нітрогену дорівнює –3;

д) у попередньому прикладі встановлено, що ступені окиснення атомів елементів N і Н у йоні амонію  становлять відповідно: –3 і +1. Оскільки заряд йона
становлять відповідно: –3 і +1. Оскільки заряд йона  дорівнює +1, то зрозуміло, що заряд сполученого з ним нітрат-іона NO3– повинен дорівнювати –1. Тоді ступінь окиснення х атома N в NO3– дорівнює :
дорівнює +1, то зрозуміло, що заряд сполученого з ним нітрат-іона NO3– повинен дорівнювати –1. Тоді ступінь окиснення х атома N в NO3– дорівнює :
х + 3.( –2) = –1, звідки х = +5.
 .
.
Приклад 2 Заповніть пропуски в наведених схемах, зазначте процеси окиснення та відновлення: а)  ; б)
; б) 
Розв’язання:а) У лівій і правій частинах схеми кількість атомів Сульфуру однакова, а ступінь окиснення зменшується на два. Зменшення ступеня окиснення відбувається за рахунок приєднання двох електронів у результаті процесу відновлення:
|
|
|

б) у лівій частині схеми міститься два атоми Оксигену зі ступенем окиснення –2, тому сума їх ступенів окиснення становить –4. Схема показує віддавання чотирьох електронів, що відповідає процесу окиснення, внаслідок якого сумарне значення ступеня окиснення у атомів Оксигену підвищується до 0. Такий ступінь окиснення цей елемент має у простій речовині  . Збільшення ступеня окиснення відбувається за рахунок втрати електронів у результаті процесу окиснення:
. Збільшення ступеня окиснення відбувається за рахунок втрати електронів у результаті процесу окиснення: 
Приклад 3За наведеними схемами визначте тип окисно-відновної реакції:
а)  ; б)
; б)  ;
;
в)  .
.
Розв’язання: а) визначаємо ступені окиснення елементів і відмічаємо ті, які змінили свій ступінь окиснення:


Елемент-окисник (  , оскільки його атоми знижують ступінь окиснення) та елемент-відновник (
, оскільки його атоми знижують ступінь окиснення) та елемент-відновник (  , ступінь окиснення підвищується) входять до складу різних речовин, що свідчить про належність наведеної окисно-відновної реакції до міжмолекулярного типу;
, ступінь окиснення підвищується) входять до складу різних речовин, що свідчить про належність наведеної окисно-відновної реакції до міжмолекулярного типу;
б) визначаємо ступені окиснення тих елементів, у атомах яких відбулося їх змінення:
|
|
|
 .
.
Атоми елементів окисника (  ) та відновника (
) та відновника (  ) входять до складу однієї речовини, отже, це внутрішньомолекулярна окисно-відновна реакція;
) входять до складу однієї речовини, отже, це внутрішньомолекулярна окисно-відновна реакція;
в) визначаємо ступені окиснення атомів елементів і відмічаємо ті, що змінилися:
 .
.
Частина атомів Оксигену (  ), що входить до складу однієї сполуки, окиснюється (до
), що входить до складу однієї сполуки, окиснюється (до  ), а інша частина – відновлюється (до
), а інша частина – відновлюється (до  ). Отже, це окисно-відновна реакція диспропорціонування.
). Отже, це окисно-відновна реакція диспропорціонування.
Приклад 4Які з наведених речовин:  ,
,  ,
,  - можуть виявляти: а) тільки окисні властивості; б) тільки відновні властивості; в) окисно-відновну двоїстість.
- можуть виявляти: а) тільки окисні властивості; б) тільки відновні властивості; в) окисно-відновну двоїстість.
Розв’язання: а) визначаємо ступені окиснення атомів елементів у сполуці:
 .
.
Елемент Mn перебуває у вищому ступені окиснення, який більше не може підвищуватися. Тому атоми Mn+7 не спроможні віддавати електрони, але здатні приєднувати їх, тобто речовина KMnO4 за рахунок Mn+7може виявляти тільки окисні властивості;
б) визначаємо ступені окиснення елементів у сполуці:
 .
.
Елемент Mnу сполуці MnO2 виявляє проміжний ступінь окиснення, тому він здатен як віддавати, так і приєднувати електрони. Отже, ця речовина за рахунок Mn+4може виявляти окисно-відновну двоїстість;
в) визначаємо ступені окиснення елементів у сполуці:
|
|
|
 .
.
Атоми елемента І знаходяться у нижчому ступені окиснення, тому не можуть знижувати його ще сильніше (за рахунок приєднання електронів), але здатні підвищувати ступінь окиснення внаслідок віддавання електронів. Таким чином, речовина КІ за рахунок І–1 може виявляти тільки відновні властивості.
Приклад 5На підставі методу електронного балансу розставте коефіцієнти в наведених схемах окисно-відновних реакцій, зазначте окисник і відновник, процеси окиснення та відновлення:
а) 
б) 
Розв’язання.Для того щоб розставити коефіцієнти у рівнянні хімічної реакції методом електронного балансу, дотримуються такого алгоритму:
1 Визначають ступені окиснення елементів у речовинах і встановлюють, які елементи змінили свої ступені окиснення.
2 Складають схеми процесів окиснення і відновлення.
3 Підбираючи відповідні множники, зрівнюють кількість відданих та прийнятих електронів – складають електронний баланс.
4 Розставляють коефіцієнти в рівнянні хімічної реакції, спочатку зрівнюючи кількість атомів елементів, що змінили свій ступінь окиснення, потім елементів-металів, елементів-неметалів, серед яких, як правило, кількість атомів Оксигену зрівнюють в останню чергу.
а)  .
.
 │3│ - процес окиснення,
│3│ - процес окиснення,
елемент-відновник;
 │2│ - процес відновлення,
│2│ - процес відновлення,
елемент-окисник.
Розставляємо коефіцієнти перед формулами речовин, які містять атоми елементів, що змінили свій ступінь окиснення. При цьому враховуємо, що серед продуктів реакції є атоми N+4 і N+5, тобто не всі атоми Нітрогену (в лівій частині рівняння N+5) змінили свій ступінь окиснення, тому отриманий за балансом для Нітрогену коефіцієнт 2 ставимо лише перед формулою NO:
3PbS + HNO3→3S + 2NO + 3Pb(NO3)2 + H2O.
Після цього підраховуємо загальну кількість атомів Нітрогену у формулах нітрогеновмісних сполук правої частини рівняння (оскільки у цій частині рівняння коефіцієнти перед сполуками, що містять Нітроген, розставлені): 2NO, 3Pb(NO3)2; вона дорівнює 8. Ставимо цей коефіцієнт перед нітратною кислотою:
 8
8 
Видно, що кількість атомів Гідрогену у лівій частині рівняння дорівнює 8 (перед формулою HNO3). Отже, перед формулою H2O ставимо коефіцієнт 4:
 4
4 
Перевіряємо загальну кількість атомів Оксигену: у лівій і у правій частинах рівняння вона однакова і дорівнює 24. Коефіцієнти у рівнянні хімічної реакції розставлені правильно.
б) Аналіз схеми дозволяє зробити висновок, що ступені окиснення змінюються лише у атомів елемента Мангану, оскільки і в лівій, і в правій частинах рівняння реакції сульфат-іон  залишається незмінним, а елементи
залишається незмінним, а елементи  ,
,  ,
,  входять до складу складних речовин і виявляють постійні, характерні для них ступені окиснення (+1, –2 і +1 відповідно). Тому є необхідність визначати ступінь окиснення лише у елемента
входять до складу складних речовин і виявляють постійні, характерні для них ступені окиснення (+1, –2 і +1 відповідно). Тому є необхідність визначати ступінь окиснення лише у елемента  :
:


 │2│ – процес відновлення,
│2│ – процес відновлення,
елемент-окисник;
 │3│ – процес окиснення,
│3│ – процес окиснення,
елемент-відновник.
Розставляємо коефіцієнти, починаючи зі сполук, що містять атоми елемента Mn, який змінив свій ступінь окиснення. У лівій частині схеми перед формулою  , що містить
, що містить  , ставимо коефіцієнт 2, а перед формулою
, ставимо коефіцієнт 2, а перед формулою  , що містить
, що містить  , коефіцієнт 3. Тоді у правій частині схеми перед формулою
, коефіцієнт 3. Тоді у правій частині схеми перед формулою  , що містить
, що містить  ,) необхідно поставити коефіцієнт 5, який визначається сумою коефіцієнтів, отриманих в електронному балансі для процесів окиснення та відновлення (2 + 3 = 5):
,) необхідно поставити коефіцієнт 5, який визначається сумою коефіцієнтів, отриманих в електронному балансі для процесів окиснення та відновлення (2 + 3 = 5):
2 
 3
3  5
5  .
.
Наступним кроком є розстановка коефіцієнтів перед формулами речовин з рештою елементів. Перевіряємо загальну кількість атомів елемента-металу  K у лівій і правій частинах схеми: вона однакова і дорівнює 2. Для оптимізації процесу розстановки коефіцієнтів доречно ті фрагменти формул, що не змінилися протягом реакції, розглядати блоками: у даному випадку – це сульфат-іони SO42–. Їх кількість у лівій частині схеми дорівнює 3 (3MnSO4). Однак у правій частині сульфат-іони містяться у двох сполуках (K2SO4, H2SO4). Щоб загальна кількість SO42– у названих речовинах дорівнювала 3, слід поставити коефіцієнт 2 саме перед формулою H2SO4, а не К2SO4, оскільки кількість атомів елемента K збільшувати не можна:
K у лівій і правій частинах схеми: вона однакова і дорівнює 2. Для оптимізації процесу розстановки коефіцієнтів доречно ті фрагменти формул, що не змінилися протягом реакції, розглядати блоками: у даному випадку – це сульфат-іони SO42–. Їх кількість у лівій частині схеми дорівнює 3 (3MnSO4). Однак у правій частині сульфат-іони містяться у двох сполуках (K2SO4, H2SO4). Щоб загальна кількість SO42– у названих речовинах дорівнювала 3, слід поставити коефіцієнт 2 саме перед формулою H2SO4, а не К2SO4, оскільки кількість атомів елемента K збільшувати не можна:

 2
2  .
.
Тепер підраховуємо кількість атомів Гідрогену: у правій частині схеми воно дорівнює 4 (2H2SO4). Отже, перед формулою H2O у лівій частині схеми ставимо коефіцієнт 2:
 2
2  .
.
Перевіряємо загальну кількість атомів Оксигену без урахування числа тих атомів О, які входять до складу сульфат-іонів: у лівій (2KMnO4, 2H2O) і у правій (5MnO2) частинах рівняння вона однакова і дорівнює 10. Отже, коефіцієнти у рівнянні хімічної реакції розставлені правильно.
Приклад 6 Які процеси будуть спостерігатися, якщо шматочок натрію помістити у розчин мідного купоросу?
Розв’язання. Як випливає з ряду електрохімічних напруг металів, натрій є набагато активнішим від міді, однак при його контакті з розчином мідного купоросу Na взаємодіє не з CuSO4, а з водою. Отже, буде спостерігатися виділення водню:
 .
.
Крім того, натрій гідроксид, що при цьому утворюється, почне реагувати з купрум (ІІ) сульфатом, внаслідок чого випадає осад блакитного кольору:
 .
.
П риклад 7 Складіть схеми двох гальванічних елементів, в одному з яких галієвий електрод був би катодом, а в іншому – анодом. Зазначте напрямок електричного струму в зовнішньому ланцюзі. Складіть рівняння окисно-відновних напівреакцій, що відбуваються на електродах, та сумарні рівняння ОВР, які відповідають роботі гальванічних елементів.
Розв’язання. Стандартний електродний потенціал галію дорівнює –0,529В (додаток Е). Для складання схеми гальванічного елемента, в якому галій був би анодом, за катод необхідно вибрати метал із більшим значенням електродного потенціалу, який в електрохімічному ряді розміщується праворуч від галію. Таким металом може бути мідь, оскільки  B.
B.
 В. Тоді схема гальванічного елемента має вигляд
В. Тоді схема гальванічного елемента має вигляд

Внаслідок замикання зовнішнього ланцюга в мідно-галієвому елементі відбуваються електродні процеси:
анод: 
катод:  .
.
Отже, електричний струм у зовнішньому ланцюзі переміщується від галієвого анода у бік мідного катода.
Сумарне рівняння ОВР

Для складання гальванічного елемента, в якому галій був би катодом, для анода треба вибрати метал, потенціал якого має менше значення, ніж потенціал галію, наприклад берилій, оскільки  B.
B.
Необхідно зазначити, що використовувати у ролі анода лужні чи лужноземельні метали, які мають найменші значення ε0, недоцільно, тому що завдяки високій хімічній активності вони взаємодіятимуть з розчином електроліту.
Схема гальванічного елемента

При замиканні зовнішнього ланцюга електричний струм проходить від берилію до галію, що відображається напівреакціями
анод: 
катод:  .
.
Сумарне рівняння ОВР
 .
.
Приклад 8 Для гальванічного елемента

розрахуйте стандартну електрорушійну силу Е0, змінення енергії Гіббса  і ЕРС, що виникає при використанні розчинів електролітів концентрацій
і ЕРС, що виникає при використанні розчинів електролітів концентрацій 

Розв’язання. Стандартна ЕРС берилієво-галієвого елемента визначається різницею між стандартними потенціалами катода і анода: (додаток Е):

Змінення енергії Гіббса пов’язане з ЕРС таким співвідношенням:

де z – загальна кількість електронів, що беруть участь у сумарному окисно-відновному процесі, де для розглянутого випадку n = 6; F - стала Фарадея.
 Від’ємне
Від’ємне  значення енергії Гіббса
значення енергії Гіббса  підтверджує самочинний перебіг електродних процесів при роботі берилієво-галієвого елемента.
підтверджує самочинний перебіг електродних процесів при роботі берилієво-галієвого елемента.
Для знаходження ЕРС, яка виникає при використанні зазначених розчинів електролітів, спочатку необхідно розрахувати значення електродних потенціалів за рівнянням Нернста

При заданих концентраціях електроліту електродні потенціали дорівнюють: 

Тоді ЕРС елемента

Приклад 9 Які продукти і в якій послідовності утворюються на катоді при електролізі водного розчину, що містить суміш солей: 



Розв’язання. Порівнюючи стандартні електродні потенціали відповідних систем (додаток Е) і беручи до уваги правила розрядки на катоді, відповідно до яких легше відновлюються катіони з вищим значенням стандартного електродного потенціала, можна визначити послідовність розрядки катіонів:
1 
2 
3 
Після виділення перелічених металів розчин, який і спочатку мав кисле середовище внаслідок гідролізу солей
 стає ще кислішим, тому наступним процесом буде відновлення йонів Гідрогену за схемою
стає ще кислішим, тому наступним процесом буде відновлення йонів Гідрогену за схемою
4 
Катіони натрію, значення електродного потенціалу якого становить -2,714 В, з водних розчинів відновлюватися не будуть.
Приклад 10Для якого електроліту –  чи
чи  – можна провести електроліз водного розчину, використовуючи: а) тільки інертні електроди; б) як інертний, так і розчинний аноди. Скласти схеми електролізу.
– можна провести електроліз водного розчину, використовуючи: а) тільки інертні електроди; б) як інертний, так і розчинний аноди. Скласти схеми електролізу.
Розв’язання. З інертним анодом можна провести електроліз броміду калію. Оскільки калій належить до дуже активних металів, то на катоді відновлюється вода

У прикатодному просторі накопичуються йони  та
та  , тому первинним продуктом електролізу на катоді є водень, а вторинним –
, тому первинним продуктом електролізу на катоді є водень, а вторинним – 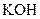 .
.
На аноді окиснюються йони брому, які належать безоксигенній кислоті

Продуктом електролізу є рідкий бром.
Сумарне рівняння реакції електролізу

Як матеріал для розчинного анода при електролізі водного розчину солі  необхідно взяти бісмут. Тоді напівреакції, що відображають сутність катодного і анодного процесів, мають такий вигляд:
необхідно взяти бісмут. Тоді напівреакції, що відображають сутність катодного і анодного процесів, мають такий вигляд:


Електроліз цієї солі можна провести і на інертних електродах:
 │ 4
│ 4
 │ 3
│ 3
У прианодному просторі накопичуються йони  i
i  , тому вторинним продуктом електролізу є
, тому вторинним продуктом електролізу є  , а основними продуктами – вісмут і кисень.
, а основними продуктами – вісмут і кисень.
Сумарне рівняння електролізу

Приклад 11 Складіть рівняння реакцій, що відбуваються на інертних електродах під час електролізу розчину  Розрахуйте, який об’єм газу (н. у.) виділиться на аноді при пропусканні через цей розчин електричного струму силою
Розрахуйте, який об’єм газу (н. у.) виділиться на аноді при пропусканні через цей розчин електричного струму силою  протягом 0,5 години.
протягом 0,5 години.
Розв’язання. Якщо  то на катоді відновлюються катіони металу. Електродний потенціал
то на катоді відновлюються катіони металу. Електродний потенціал  тому на катоді відновлюються катіони. Електродний потенціал
тому на катоді відновлюються катіони. Електродний потенціал 
 │ 2.
│ 2.
Згідно з правилами розрядки у розчинах на аноді аніони  не окиснюються, замість них окиснюються молекули води:
не окиснюються, замість них окиснюються молекули води:
 │ 1.
│ 1.
Сумарне рівняння електролізу водного розчину  :
:

За законом Фарадея розраховуємо об’єм кисню, що виділився на аноді:

Приклад 12Опишіть процеси, що відбуваються під час корозії цинку та нікелю, які контактують, зазначте катод та анод.
Розв’язання. Під дією окисника зовнішнього середовища кородує метал, який знаходиться в контакті з менш активною електропровідною сумішшю. Необхідною умовою кородування металу є вище значення потенціалу корозійного середовища порівняно з потенціалом металу:
 Слід пам’ятати, що для води
Слід пам’ятати, що для води
 а для вологого повітря
а для вологого повітря


Із зіставлення взаємного розміщення металів у ряді стандартних електродних потенціалів випливає, що цинк активніший, ніж нікель, тому при контакті  і
і  у вологому повітрі виникає корозійний гальванічний елемент, схему якого записують так:
у вологому повітрі виникає корозійний гальванічний елемент, схему якого записують так:

У даному корозійному гальванічному елементі роль анода відіграє більш активний цинк, він піддається окисненню. Катодом є менш активний нікель, на ньому проходить відновлення окисника із корозійного середовища, яким у даному прикладі є вологе повітря (О2, Н2О). Запишемо схеми процесів, що відбуваються при цьому:



Завдання для самоперевірки
Завдання 1-20 мають чотири варіанти відповіді, з яких тільки одна правильна.
1 Виберіть характеристику відновника.
А речовина, атоми якої віддають електрони і підвищують ступінь окиснення;
Б речовина, атоми якої приєднують електрони і знижують ступінь окиснення;
В речовина, яка приймає електрони і при цьому відновлюється;
Г речовина, атоми якої приєднують електрони і підвищують свій ступінь окиснення.
2 Яке твердження стосується речовини, яка виявляє лише окисні властивості:
А тільки віддає електрони;
Б тільки приєднує електрони;
В не змінює ступеня окиснення елементів;
Г може як приєднувати, так і віддавати електрони?
3 Виберіть пару реагентів, реакція між якими є окисно-відновною:
А кислота і луг; Б основний оксид і кислота;
В метал і кислота; Г нерозчинна основа і кислота.
4 В якій сполуці Сульфур виявляє вищий ступінь окиснення:
А  Б
Б  В
В  Г NaHSO3?
Г NaHSO3?
5 Виберіть рядок ступенів окиснення Нітрогену відповідно до послідовності сполук: NH3, N2O, NO2, N2O5:
А +3, +2, +2, +5; Б -3, +2, +4, +2;
В -3, +1, +4, +5; Г +3, -1, +5, +4.
6 Назвіть сполуку, в якій Бром може виявляти тільки відновні властивості:
А  Б
Б  В
В  Г FeBr3.
Г FeBr3.
7 Яка схема відображає процес відновлення:
А  Б
Б 
В  Г V0→V+3?
Г V0→V+3?
8 Замість крапок вставте пропущені символи:As+3…As-3:
А  Б
Б  В
В  Г
Г 
9 До якого типу належить окисно-відновна реакція
AgNO3 → Ag + NO2 + O2:
А диспропорціонування;
Б внутрішньомолекулярна;
В міжмолекулярна;
Г самоокиснення-самовідновлення?
10 На основі електронного балансу розставте коефіцієнти у рівнянні окисно-відновної реакції і зазначте суму всіх коефіцієнтів:

А 26; Б 24; В 23; Г 21.
11 Переважно за яким механізмом виникає подвійний електричний шар при зануренні нікелевої пластини у розчин солі NiSO4:
А адсорбційним; Б дифузійним;
В йоногенним; Г біоелектричним?
12 Виходячи зі значень стандартних електродних потенціалів, оберіть метал з найбільшою відновною активністю:

А  Б
Б  В
В  Г
Г 
13 Мідні пластини однакової маси занурені у розчини солей:  В якому випадку маса пластини збільшиться, якщо стандартні електродні потенціали дорівнюють:
В якому випадку маса пластини збільшиться, якщо стандартні електродні потенціали дорівнюють:


А  Б
Б  В
В  Г
Г 
14 Обчисліть електродний потенціал цинку при 298 К і концентрації йонів цинку  якщо
якщо  :
:
А –0,76 В; Б –0,70 В; В –0,819 В; Г –0,059 В.
15 Схема гальванічного елемента має вигляд

Яке значення може мати концентрація x (моль/л):
А  Б
Б  В
В  Г 10-3?
Г 10-3?
16 В якій послідовності будуть відбуватися процеси відновлення на катоді при електролізі водного розчину, що містить суміш солей NaNO3, AgNO3, Pb(NO3)2:

А 
Б 
В 
Г H2, Ag, Na?
17 Яка маса речовини утворюється на катоді і який об’єм газу (н. у.) виділяється на аноді, якщо під час електролізу водного розчину  було витрачено 96500 Кл електрики:
було витрачено 96500 Кл електрики:

А 
Б 
В 
Г 18,7 г Fe і 11,2 л Cl2?
18 Які процеси проходять на катодних ділянках при атмосферній корозії лудженого (покритого оловом) заліза при порушенні покриття:

А 
Б 
В 
Г  ?
?
19 Як називається корозійний процес, під час якого відбувається відновлення  на катодних ділянках у корозійному гальванічному елементі:
на катодних ділянках у корозійному гальванічному елементі:
А корозія з водневою деполяризацією;
Б киснева корозія;
В корозія з кисневою деполяризацією;
Г фретинг-корозія?
20 Як називається метод захисту металу від корозії шляхом нанесення на його поверхню шару більш активного металу:
А катодне покриття; Б протекторний захист;
В анодне покриття; Г катодний захист?
Дата добавления: 2019-02-13; просмотров: 154; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
