Второе индивидуальное задание.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Для студентов-заочников по курсу «ХИМИЯ»
Студент получает своё индивидуальное задание в соответствии со своим порядковым номером в списке группы и соответствующем номере задания (билета) - (1-й порядковый номер в группе – 1-й порядковый номер билета в индивидуальном домашнем задании и т.д. Если список группы превышает 20 человек, то 21-й выполняет 1-й порядковый номер билета, 22-й – 2-ой и т.д.). Для получения допуска к зачету (экзамену) необходимо выполнить работы по трём индивидуальным заданиям курса «Химии»
Первое индивидуальное задание.
Основные классы неорганических соединений. Количественные расчеты. Химическая термодинамика
Билет N 1.
1. Из перечисленных оксидов выберите один основной и один кислотный, докажите их кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
CoO, CaO, SO2, NiO, Cr2O3, V2O5, CO2
2. Сколько молей KMnO4 необходимо для взаимодействия с 152 г FeSO4 по реакции:
KMnO4+ FeSO4+ H2SO4ÞK2SO4+MnSO4+ Fe2(SO4)3+ H2O.
3. Вычислить тепловой эффект реакции
CH4 + CO2 = 2CO + 2 H2
DfHo кДж/моль -74.85 -393,5 -110,5 0
где DfHo - энтальпии образования соответствующих веществ.
Билет N 2.
1. Написать формулы гидроксидов, соответствующих следующим оксидам: Cs2O, MnO, CrO3, V2O3, SO3, PbO. Для амфотерного гидроксида показать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и сокращенной ионной форме.
|
|
|
2. Сколько литров диоксида азота (NO2) образуется при растворении 1.28г металлической меди в азотной кислоте:
Cu + HNO3 Þ Cu(NO3)2 + NO2+ H2O
3. Возможно ли восстановление оксида висмута оксидом углерода при Т = 800 К по реакции (энтальпии образования (DfHo) и энтропии (So) веществ известны):
Bi2O3 + 3CO = 2Bi + 3CO2
DfHo кДж/моль -570,70 -110,53 0 -393,51
So Дж/моль*К 151,49 197,55 56,9 213,66
Билет N 3.
1. Получить дигидроксид никеля (основной), доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Сколько граммов KClO3 необходимо для получения 11.2 л газа Cl2 по реакции: KClO3+ HCl Þ KCl + Cl2+ H2O
3. Какое количество теплоты выделилось при сгорании водорода в кислороде, если в процессе горения образовалось 3,6 г водяного пара. DfHo вод.пар = -241,81 кДж/моль
Билет N 4.
1. Из перечисленных оксидов выберите амфотерный и докажите его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
CdO, Cu2O, SO3, NiO, Cr2O3, V2O3, CO2, N2O3, SnO
2. Сколько литров диоксида азота (NO2) образуется при растворении 1.08г металлического серебра в азотной кислоте:
Ag + HNO3 Þ AgNO3 + NO2+ H2O
|
|
|
3. Определить тепловой эффект реакции образования 73 г гексафторида серы (SF6) из простых веществ.
DfHo (SF6) = -1221,0 кДж/моль
Билет N 5
1. Из перечисленных оксидов выберите один основной и один кислотный, докажите их кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
CdO, CaO, SO2, Na2O, Cr2O3, Nb2O5, CO2
2. Сколько граммов KMnO4 необходимо для получения 11.2 л газа Cl2 по реакции:
KMnO4+ HCl ÞKCl+MnCl2+ Cl2+ H2O
3. Вычислить тепловой эффект реакции восстановления оксида железа (III) оксидом углерода (II):
Fe2O3 + CO = 2FeO + CO2
DfHo кДж/моль -882,2 -110,5 -264,9 -393,5
где DfHo - энтальпии образования соответствующих веществ.
Билет N 6.
1. Получить нерастворимый дигидроксид бериллия. Показать его амфотерные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Сколько литров диоксида азота (NO) образуется при растворении 2.56г металлической меди в разбавленной азотной кислоте:
Cu + HNO3 Þ Cu(NO3)2 + NO+ H2O
3. Вычислить энтальпию образования селеноводорода (H2Se), если при образовании 2 л (н.у.) H2Se из водорода и селена поглотилось 7,66 кДж теплоты.
Билет N 7
1. Получить дигидроксид марганца (основной) и доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
|
|
|
2. Сколько молей K2Cr2O7 необходимо для получения 6.4 г серы по реакции:
K2Cr2O7 + Na2S + H2OÞCr(OH)3¯ + S¯ + KOH +NaOH
3. Оценить термодинамическую возможность окисления меди кислородом при стандартно температуре по реакции:
2Cu + O2 = 2 CuO
DfHo кДж/моль 0 0 -162.0
So Дж/мольּК 33.14 205.04 42.63
Билет N 8.
1. Показать кислотно-основные свойства оксидов никеля (NiO -основной) и фосфора (P2O5 - кислотный). Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Сколько литров диоксида азота (NO) образуется при растворении 0.59г металлического никеля в разбавленной азотной кислоте:
Ni+ HNO3 Þ Ni(NO3)2 + NO+ H2O
3. Определить тепловой эффект реакции горения ацетона (C3H6O) в кислороде, если известны его энтальпия образования DfHo (C3H6O) = -248.11 кДж/моль и энтальпии образования продуктов сгорания DfHo (CO2)=-393,5кДж/моль и DfHo(H2O)=-285,8 кДж/моль.
Билет N 9.
1. Из перечисленных оксидов выберите амфотерный и докажите его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
CdO, Cu 2O, SO3, NiO, Cr2O3, V2O3, CO2, N2O3, SnO
2. Сколько молей K2Cr2O7 необходимо для окисления 3.78 г сульфита натрия по реакции:
|
|
|
K2Cr2O7 + Na2SO3 + HNO3 Þ Cr(NO3)3 + Na2SO4+ KNO3 + H2O
3. Оценить температуры, при которых возможно самопроизвольное протекание реакции (энтальпии образования (DfHo) и энтропии (So) реагентов и продуктов реакции известны):
CO2(г) + C(гр) = 2CO(г)
DfHo кДж/моль -393.51 0 -110.53
So Дж/моль*К 213.66 5.74 197.55
Билет N 10.
1. Из перечисленных оксидов выберите амфотерный и докажите его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
CdO, Cu2O, SO3, NiO, Al2O3, V2O5, CO2, N2O5, SnO2
2. Сколько литров диоксида серы (SO2) образуется при растворении 5.9г металлического кобальта в концентрированной серной кислоте:
Co+ H2SO4 Þ CoSO4 + SO2+ H2O
3. Возможно ли восстановление оксидов CuO и Na2O газообразным водородом при стандартных условиях (известны величины энергий Гиббса (DGof) для оксидов и продуктов восстановления).
CuO + H2 = Cu + H2O
DfGo кДж/моль -134.26 0 0 -237.23
Na2O + H2 = 2Na + H2O
DfGo кДж/моль -379.26 0 0 -237.23
Билет N 11.
1. Получить дигидроксид свинца (амфотерный) и доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Сколько молей диоксида свинца PbO2 необходимо для окисления 8.7 г диоксида марганца MnO2 по реакции:
PbO2+ MnO2+ KOH Þ KMnO4+ K2PbO2+H2O
3. Оценить термодинамическую возможность самопроизвольного протекания реакции образования азотной кислоты из азота, кислорода и воды при стандартных условиях (известны величины энергий Гиббса (DGof) для реагентов).
N2 + 2.5O2 + H2O(жидк.) = 2HNO3(жидк.)
DfGo кДж/моль 0 0 -237.23 -79.90
Билет N 12.
1. Написать формулы гидроксидов, соответствующих следующим оксидам: Cs 2 O, Mn2O7, Fe 2 O 3, CrO3, SO3, PbO. Для одного основного иодного кислотного гидроксида показать кислотно-основные свойства. Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Сколько литров газа сероводорода (H2S) может быть окислено в 1л раствора перманганата калия (KMnO4) концентрации 0.8 моль/л по реакции:
H2S + KMnO4+ H2SO4 Þ MnSO4 + K2SO4+ H2O
3. Какое количество теплоты выделится при сгорании 100 г гептана (C7H16). Энтальпии образования гептана и продуктов сгорания равны:
C7H16 CO2 H2O(жидк.)
DfHo кДж/моль -224.54 -393,5 -285,8
Билет N 13.
1. Написать формулы гидроксидов, соответствующих следующим оксидам: Rb2O, PbO, Cr2O3, N 2 O 5 , SO 3. Для одного кислотного гидроксидов показать кислотно-основные свойства. Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Сколько литров газа хлора (Cl2) может быть поглощено 1л водного раствора Na2S2O3 концентрации 1 моль/л при протекании реакции:
Cl2 + Na2S2O3 + H2O Þ Na2SO4 + HCl + H2SO4
3. Определить термодинамическую возможность протекания химической реакции в стандартных условиях (энтальпии образования (DfHo) и энтропии (So) веществ известны):
CO(г) + PbO(кр) = CO2(г) + Pb(кр)
DfHo кДж/моль -110.53 -217.61 -393.51 0
So Дж/моль*К 197.55 68.70 213.66 64.81
Билет N 14.
1. Получить дигидроксид олова (амфотерный) и доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Какое количество хлората калия (KClO3) надо добавить к 1.86 г фосфора для стехиометрического протекания реакции:
KClO3 + P Þ P2O5 + KCl
3. Определить направление самопроизвольного протекания химической реакции в стандартных условиях. (Энтальпии образования (DHof) и энтропии (So) веществ известны):
CO(г) + H2O(г) = CO2(г) + H2(г)
DfHo кДж/моль -110.53 -241.81 -393.51 0
So Дж/моль*К 197.55 188.72 213.66 130.52
Билет N 15.
1. Получить дигидроксид кобальта (основной) и доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Какое количество перхлората калия (KClO4) надо добавить к 2.16 г алюминия для стехиометрического протекания реакции:
KClO4 + Al Þ Al2O3 + KCl
3. Какое количество теплоты выделится при сгорании 2,6 г ацетилена (C2H2). Энтальпии образования ацетилена и продуктов сгорания равны:
C2H2 CO2 H2O(жидк.)
DfHo кДж/моль +226,8 -393,5 -285,8
Билет N 16.
1. Написать формулы гидроксидов, соответствующих следующим оксидам: Na2O, PbO, Al 2 O 3, SO2, CrO3. Выбрать амфотерный гидроксид и показать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и сокращенной ионной форме
2. Какой объем газа оксида азота (NO) образуется при окислении 0.96г сульфида меди (CuS) азотной кислотой по реакции:
CuS + HNO3 Þ CuSO4 + NO + H2O
3. Определить направление самопроизвольного протекания химической реакции в стандартных условиях. (Энтальпии образования (DfHo кДж/моль) и энтропии (So Дж/моль·К) веществ известны):
2MgO(кр)+2Cl2(г) + C(гр) = CO2(г) + 2MgCl2(кр)
DfHo -601.49 0 0 -393.51 -644.80
So 27.07 222.98 5.74 213.66 89.54
Билет N 17.
1. Получить дигидроксид железа (основной) и доказать его кислотно-основные свойства. Уравнения реакций написать в молекулярной и в сокращенной ионной форме.
2. Сколько молей KMnO4 необходимо для взаимодействия с 1.89 г SnCl2 по реакции:
KMnO4 + SnCl2 + HCl Þ KCl + MnCl2 + SnCl4 + H2O
3. Определить направление самопроизвольного протекания химической реакции в стандартных условиях. (Энтальпии образования (DHof) и энтропии (So) веществ известны):
NH3(г) + HCl(г) = NH4Cl(кр)
DfHo кДж/моль -45.94 -92.31 -314.22
So Дж/моль*К 192.66 186.79 95.81
Билет N 18.
1. Написать формулы гидроксидов, соответствующих следующим оксидам: Cs 2 O, Mn2O7, TiO2, FeO, CrO3, NiO, V2O3, SO3, PbO. Для одного основного гидроксида показать кислотно-основные свойства. Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Сколько литров диоксида серы (SO2) образуется при растворении 5.6г металлического железа в концентрированной серной кислоте:
Fe + H2SO4 Þ Fe2(SO4)3 + SO2+ H2O
3. Возможна ли реакция диссоциации углекислого газа при Т=500оС по реакции:
2CO2 = 2CO + O2
DfHo кДж/моль -393.51 -110.53 0
So Дж/моль*К 213.66 197.55 205.04
Билет N 19.
1. Показать кислотно-основные свойства оксидов кобальта (CoO - основной) и марганца (Mn2O7 - кислотный). Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Какое количество перхлората калия (KClO4) надо добавить к 17 г магния для стехиометрического протекания реакции:
KClO4 + Mg Þ MgO + KCl
3. Оценить область температур, при которых существует термодинамическая возможность образования метилового спирта из окиси углерода и водорода по реакции:
CO(г) + 2H2(г) = CH3OH(г)
DHof кДж/моль -110.53 0 -201.00
So Дж/моль*К 197.55 130.52 239.76
Билет N 20.
1. Показать кислотно-основные свойства оксидов железа (FeO - основной) и азота (N2O5 - кислотный). Уравнения реакций написать в молекулярной и сокращенной ионной форме.
2. Сколько молей K2Cr2O7 необходимо для окисления 6.9 г нитрита натрия по реакции:
K2Cr2O7+NaNO2+H2SO4ÞCr2(SO4)3+K2SO4+NaNO3+H2O
3. Возможно ли восстановление оксидов CaO и Ag2O газообразным водородом при стандартных условиях (известны величины энергий Гиббса (DGof) для оксидов и продуктов восстановления).
CaO + H2 = Ca + H2O
DGof кДж/моль -603.46 0 0 -237.23
Ag2O + H2 = 2Ag + H2O
DGof кДж/моль -10.90 0 0 -237.23
Второе индивидуальное задание.
Кинетика, химическое равновесие. Равновесие в растворах, фазовые равновесия. Диаграммы состояния. Электрохимические процессы. Гальванические элементы, электролиз электролитов, коррозия
БИЛЕТ № 1
1. Какая из перечисленных солей подвергается гидролизу: NaNO3, KCN, KCl, Na2SO4? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации основания равна Ка = 4.9·10-10.
2. Равновесие реакции Н2 +I2 = 2HI установилось при следующих концентрациях: [H2]=0.5моль/л; [I2]=0.1моль/л; [HI]=1.8моль/л. Определите константу химического равновесия и исходные концентрации иода и водорода. В начальный момент времени [HI]=0.
3.
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии хромированного железного изделия в водном растворе с рН<7 при нарушении покрытия?
5. Составить гальванический элемент, в котором медь является анодом. Написать уравнения реакций, протекающих на электродах, и вычислить ЭДС в стандартных условиях и при концентрации ионов меди у анода равной 0.001 моль/л.
6. При электролизе водного раствора соли сульфата MeSO4 в течение 12 минут с током 5А на катоде выделилось 2,0966 г этого металла. Определить металл, вычислив его атомную массу. Какой продукт, и в каком количестве выделится на инертном аноде?
БИЛЕТ № 2
1. Какая из перечисленных солей подвергается гидролизу: CuSO4, Na2SO4, KNО3? Рассчитать рН раствора, если концентрация этой соли равна 1 моль/л, а константа диссоциации основания равна Кb2 = 2.19·10-7.
2. При равновесии системы N2 + 3H2 Û 2NH3 концентрации веществ равны: [N2]=1,5 моль/л, [H2] = 4,5 моль/л, [NH3] = 2,0 моль/л. Рассчитать константу химического равновесия и исходные концентрации водорода и азота, если концентрация аммиака в исходной смеси равна 0.
3. Рассчитать температуру кристаллизации 9.5 % водного раствора хлорида магния (МаCl2), приняв степень диссоциации соли равной 1. Ккр = 1.86 К·кг/моль
4. Какие коррозионные процессы возможны при погружении в воду с рН7 серебряного изделия, включающего в себя медные детали?
5. Составить концентрационный гальванический элемент с медными электродами. Вычислить ЭДС, если концентрации ионов Cu2+ у электродов равны 0.1 моль/л и 0.001 моль/л. Написать электродные процессы.
6. При электролизе водного раствора сульфата алюминия (Al2(SO4)3) на неактивном аноде выделилось 280 мл газа. Какое это вещество? Какой продукт, и в каком количестве выделился на катоде?
БИЛЕТ № 3
1. Какая из перечисленных солей подвергается гидролизу: CaCl2, Ca(NO3)2, KJ, Na2HPO4. Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка2 = 6.2•10-8.
2. Как изменятся равновесные концентрации реагентов реакции 4НС1 + О2 = =2С12 + 2 Н2О если повысить температуру (∆rН < 0)?
3. Описать переход 1 → 2
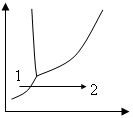
4. Какие возможны коррозионные процессы при погружении кобальтовых пластин, скрепленных железными болтами в водный раствор рН»7?
5. Составить не концентрационный гальванический элемент, используя в качестве катода свинцовый электрод. Вычислить ЭДС, если концентрация Меn+ у анода и катода соответственно равны 0.001моль/л и 0.1моль/л. Написать электродные процессы.
6. При электролизе водного раствора хлорида кальция (CaCl2) на неактивном аноде выделилось 1120 мл газа. Какое это вещество? Какой продукт, и в каком количестве выделился на катоде?
БИЛЕТ № 4
1. Какая из перечисленных солей подвергается гидролизу: CоSO4, KNO3, Na2SO4? Рассчитать рН раствора, если концентрация этой соли равна 1 моль/л, а константа диссоциации основания равна Кb2 = 7.94·10-6.
2. Обратимая реакция протекает по уравнению: А + В Û С + Д. Исходная концентрация каждого из веществ в смеси составляла 1,0 моль/л. После установления равновесия концентрация вещества С стала равна 1,5 моль/л. Вычислите константу равновесия.
3. Описать переход 1® 2
| 1 |
| 2 |
4. Какие процессы электрохимической коррозии углеродистой стали протекают при наличии на ней тонкой пленки воды на воздухе?
5. Составить гальванический элемент с железным и свинцовым электродами. Вычислить ЭДС, если концентрации ионов Men+ у анода и у катода соответственно равны: 0.001 моль/л и 0.1 моль/л. Написать электродные процессы.
6. Через водный раствор хлорида алюминия (AlCl3) пропускали в течение 160.8 минут постоянный электрический ток силой 10 А. анода. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах?
БИЛЕТ № 5
1. Какая из перечисленных солей подвергается гидролизу: SnCl2, Ва(NO3)2, NaCl? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации основания равна Кb2 = 1.26·10-12.
2. В какую сторону сместится равновесие реакции N2O4 Û 2NO2 при понижении температуры (DrH >0).
3. Описать переход 1® 2
| 1 |
| 2 |
4. Написать уравнения реакций электрохимической коррозии серебряного изделия, содержащего детали припаянные оловом, протекающей в воде (рН»7).
5. Составить гальванический элемент и рассчитать значение стандартной ЭДС, если отрицательный электрод в нем изготовлен из кадмия. Как изменится ЭДС, если концентрация Cd2+ у анода будет равна 0.001 моль/л? Написать электродные процессы.
6. Какое количество электричества (в числах Фарадея) пропущено через расплав гидроксида калия, если на инертном аноде выделилось 64 г кислорода? Определить, какой продукт, и в каком количестве выделился на катоде.
БИЛЕТ № 6
1. Какая из перечисленных солей подвергается гидролизу: Na2СО3, Na2SO4, NaNO3,? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка2 = 4.68·10-11.
2. Каковы концентрации СО и СО2, если в системе установилось химическое равновесие при протекании реакции: FeO(кр) + CO(газ) Û Fe(кр) + CO2(газ) . Константа равновесия в данных условиях равна 0.5. В начальный момент времени концентрации СО = 0.05 моль/л, СО2 = 0.01 моль/л?
3.
| 1 |
| 2 |
4. Написать уравнения реакций электрохимической коррозии медного изделия, содержащего детали припаянные оловом, протекающей при его хранении во влажной атмосфере.
5. Составить гальванический элемент, в котором висмут является анодом. Вычислить ЭДС в стандартных условиях и, если уменьшить концентрацию ионов Bi+3 у анода, до 0.001 моль/л. Написать электродные процессы.
6. Предложить схему процесса нанесения цинка на металлическое изделие электрохимическим способом. Какое количество электричества (в числах F) необходимо пропустить через раствор электролита, чтобы получить слой цинка массой 6.54 г?
БИЛЕТ № 7
1. Какая из перечисленных солей подвергается гидролизу: Zn(NO3)2, Са(NO3)2, NaCl? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации основания равна Кb2 = 4.9×10-7.
2. Определите константу равновесия обратимой реакции 2NO + O2 Û 2NO2 , если равновесие установилось при следующих концентрациях реагирующих веществ: [NO2]=0,12моль/л, [NO] = 0,48моль/л, [О2] =0,24моль/л. Определите исходные концентрации NO и О2, если концентрация NO2 в начальный момент времени равнялась 0.
3. Описать переход 1® 2® 3
| 1 |
| 3 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии луженой меди при нарушении покрытия? Рассмотреть варианты различных коррозионных сред.
5. Составить гальванический элемент, состоящего из водородного и кобальтового электродов. Рассчитать ЭДС в стандартных условиях и при концентрации потенциало-определяющих ионов равной 0.01 моль/л у отрицательного электрода. Написать электродные процессы.
6. При электролизе водного раствора сульфата никеля (NiSO4) с медным катодом и никелевым анодом на катоде выделилось 5.9 г вещества. Какое это вещество? Как изменилась масса анода?
БИЛЕТ № 8
1. Какая из перечисленных солей подвергается гидролизу: K3PO4, NaCl, KNO3? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка3 = 4.6·10-13.
2. В какую сторону сместится равновесие реакции CO + H2O Û CO2 + H2 а) при увеличении температуры (DrH <0); б) при увеличении давления в системе?
3. Описать переход 1® 2
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии никелированного медного изделия в случае нарушения покрытия, находящегося в воде (рН»7)
5. Составить схему гальванического элемента, состоящего из двух кобальтовых электродов. Рассчитать ЭДС данного элемента. Концентрации электролита у анода и катода задать самостоятельно. Написать электродные процессы.
6. Металлическое изделие электрохимическим путем необходимо покрыть хромом. Предложите схему процесса. Какое количество электричества (в числах Фарадея) необходимо пропустить через раствор электролита, чтобы на изделии образовался слой хрома массой 5.2 г?
БИЛЕТ № 9
1. Какая из перечисленных солей подвергается гидролизу: СаCl2, NaNO3, AgNO3? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации основания равна Кb =9.77×10-3 .
2. В какую сторону сместится равновесие реакции 2CO + O2 Û2CO2, а) при увеличении температуры (DrH <0); б) при увеличении общего давления в системе?
3. Описать переход 1® 2
| 1 |
| 2 |
4. Какие коррозионные процессы протекают при нарушении покрытия никелированного железного изделия, которое находится в сильно разбавленном растворе кислоты (рН<7)?
5. Составить схему гальванического элемента, используя в качестве электродов магний и железо. Рассчитать ЭДС элемента в стандартных условиях и при уменьшении концентрации ионов Men+ у катода до 0.001 моль/л. Написать электродные процессы.
6. При электролизе водного раствора карбонат калия (K2СO3) с инертными электродами на катоде выделилось 4 г вещества. Какое это вещество? Какой продукт, и в каком количестве выделился на аноде?
БИЛЕТ №10
1. Какая из перечисленных солей подвергается гидролизу: Cu(NO3)2, Na2SO4, Са(NO3)2? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации основания равна Кb2 = 2.19·10-7.
2. При протекании реакции А2 + 2В2 Û 2АВ2 химическое равновесие установилось при концентрациях равных: [А2]=1,5 моль/л, [В2] = 4,5 моль/л, [АВ2] = 2,0 моль/л. Рассчитать константу равновесия и исходные концентрации веществ А2 и В2, если концентрация вещества АВ2 в исходной смеси равна 0.
3. Описать переход 1® 2®1

4. Какие процессы протекают при электрохимической коррозии изделия из магния при наличии на нем тонкой пленки воды и неравномерной аэрации?
5. Составить гальванический элемент, используя в качестве анода марганцовый электрод. Вычислить ЭДС в стандартных условиях, и ее величину при уменьшении концентрации ионов Men+ у катода до 0.01 моль/л. (Объемы электролитов у анода и катода равны). Написать электродные процессы.
6. Предложить схему процесса нанесения на металлический лист размером 20х5 см электрохимическим путем с обеих сторон слой никеля толщиной 2,64 мм (rNi=8,9г/см3). Рассчитать необходимую величину количество электричества (в числах Фарадея). Использовать в качестве электролита водный раствор сульфата никеля (NiSO4)?
Билет № 11
1. Какая из перечисленных солей подвергается гидролизу: NaНСО3, Na2SO4, KNO3? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка1 = 4.27·10-7.
2.
| 1 |
| 2 |
| 3 |
3. Описать переход 1®2®3
4. Какие коррозионные процессы протекают в случае, если медное изделие, включающее в себя свинцовые прокладки, находится в сильно разбавленном растворе кислоты (рН<7)?
5. Составить гальванический элемент, ЭДС которого в стандартных условиях равна 0.3 В. Определить, как изменится ЭДС, если концентрация ионов Men+ у катода уменьшиться до 0.1моль/л? (Объемы электролитов у анода и катода равны). Написать электродные процессы.
6. Через водный раствор фосфата натрия (Na3PO4) в течение 321.6 минут пропускали постоянный электрический ток силой 10 А. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах?
БИЛЕТ № 12
1. Какая из перечисленных солей подвергается гидролизу: Pb(NO3)2, KNO3, LiNO3, МgSO4? Рассчитать рН раствора, если концентрация этой соли равна 0.2 моль/л, а константа диссоциации основания равна Кb2 = 1.41·10-8.
2. Обратимая реакция протекает по уравнению: 2NO + O2 Û 2NO2. В какую сторону сместится химическое равновесие, если давление в системе увеличить в 3 раза.
3. Рассчитать температуру кристаллизации 11.1% водного раствора хлорида кальция (СаCl2), приняв степень диссоциации соли равной 1. Ккр = 1.86 К·кг/моль.
4. Какие коррозионные процессы протекают при хранении во влажной атмосфере кобальтового стержня, лежащего на хромированной медной подставке?
5. Составить гальванический элемент с оловянными электродами. Рассчитать ЭДС элемента. Коцентрации электролита у анода и катода задать самостоятельно. Написать электродные процессы.
6. При электролизе водного раствора нитрата серебра (AgNO3) с серебряными электродами масса одного из электродов увеличилась на 53,9 г. Как изменилась масса другого электрода, какое количество электричества (в числах Фарадея) было пропущено через электролизер?
БИЛЕТ № 13
1. Какая из перечисленных солей подвергается гидролизу: K2SO3, Na2SO4, KNO3, МgCl2? Рассчитать рН раствора, если концентрация этой соли равна 0.3 моль/л, а константа диссоциации кислоты равна Ка2 = 6.31·10-8.
2. В какую сторону сместится равновесие реакции 2SO3 Û 2SO2 + O2 а) при уменьшении температуры (DrН>0); б) при увеличении общего давления в системе?
3. Описать переход 1® 2
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии посеребренного железного изделия работающего в сильно разбавленном растворе кислоты (рН<7) при нарушении покрытия?
5. Предложить схему концентрационного гальванического элемента, состоящего из кобальтовых электродов, опущенных в растворы сульфата кобальта (CoSO4) с концентрациями ионов кобальта 0.01 и 0.0001 моль/л. Вычислить ЭДС. Написать электродные процессы.
6. Предложить электрохимический процесс получения металлического калия из КОН. Сколько времени потребуется пропускать постоянный электрический ток силой 10 А для получения 39 г металла?
БИЛЕТ № 14
1. Какая из перечисленных солей подвергается гидролизу: Li2SO4, Ве(NO3)2, KNO3, NaCl? Рассчитать рН раствора, если концентрация этой соли равна 0.01 моль/л, а константа диссоциации основания равна Кb2 = 5.01·10-9.
2. При протекании реакции А2 + 3В2 Û 2АВ3 химическое равновесие установилось при концентрациях равных: [А2]=0.5 моль/л, [В2] = 0.7 моль/л, [АВ2] = 4.0 моль/л. Рассчитать константу равновесия и исходные концентрации веществ А2 и В2, если концентрация вещества АВ3 в исходной смеси равна 0.
3. Рассчитать температуру кипения 11.7% водного раствора хлорида натрия (NaCl), приняв степень диссоциации соли равной 100%. Кэб = 0.51 К·кг/моль.
4. Какие коррозионные процессы протекают при хранении во влажной атмосфере позолоченного медного изделия при нарушении покрытия?
5. Составить гальванический элемент, используя в качестве катода пластину из висмута. Вычислить ЭДС, если концентрация ионов металла в электролите у катода равна 10 моль/л, а у анода 0.01 моль/л. Написать электродные процессы.
6. Через водный раствор хлорида натрия (NaCl) пропускали в течение 160.8 минут постоянный электрический ток силой 10 А. анода. Электроды инертные. Определить какие вещества, и в каком количестве образовались на электродах?
БИЛЕТ № 15
1. Какая из перечисленных солей подвергается гидролизу: МgCl2, Na2SO4, NaClО, KNO3? Рассчитать рН раствора, если концентрация этой соли равна 0.2 моль/л, а константа диссоциации кислоты равна Ка = 2.82·10-8.
2. В результате протекания реакции 2NO2 Û 2NO + O2 при определенной температуре и давлении система пришла в состояние химического равновесия. Как изменятся равновесные концентрации реагентов,
если увеличить давление системе.
3. Описать переход 1® 2
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии никелированного медного изделия в воде (рН»7) при нарушении покрытия?
5. Составить гальванический элемент с серебряным катодом. Написать уравнения реакций, протекающих на электродах при работе этого элемента. Вычислить ЭДС, если концентрация ионов металла у катода равна 0,1 моль/л, а у анода 0,001 моль/л. Написать электродные процессы.
6. При электролизе водного раствора соли MeCl3 в течение 160.83 минут при токе равном 10 А. с инертным анодом на катоде выделилось 69.67 г металла. Определить металл, вычислив его атомную массу. Какой продукт, и в каком количестве выделится на аноде?
БИЛЕТ № 16
1. Какая из перечисленных солей подвергается гидролизу: NaNO3, KCN, KCl, Na2SO4? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации основания равна Ка = 4.9·10-10.
2.
| 1 |
| 2 |
3. Описать переход 1® 2
4. Какие коррозионные процессы возможны при хранении золотого изделия во влажной атмосфере, детали которого спаянны серебром?
5. Составить концентрационный гальванический элемент с медными электродами. Вычислить ЭДС, если концентрации электролитов равны 0.01 и 0.001 моль/л. Написать электродные процессы.
6. Чему равно количество использованного электричества (в числах “F”), если при электролизе водного раствора сульфата кобальта (CoSO4) с инертными электродами на катоде выделилось »118 г вещества. Какое это вещество? Что и в каком количестве выделилось на аноде?
БИЛЕТ № 17
1. Какая из перечисленных солей подвергается гидролизу: Na2СО3, Na2SO4, NaNO3,? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации кислоты равна Ка2 = 4.68·10-11.
2. При равновесии системы N2 + 3H2 Û 2NH3 концентрации веществ равны: [N2]=1,5 моль/л, [H2] = 4,5 моль/л, [NH3] = 2,0 моль/л. Рассчитать константу химического равновесия и исходные концентрации водорода и азота, если концентрация аммиака в исходной смеси равна 0.
3. Описать переход 1® 2®1
| 1 |
| 2 |
4. Какие возможны коррозионные процессы при погружении кобальтовыхпластин скрепленных медными заклепками в водный раствор рН»7?
5. Составить гальванический элемент, ЭДС которого при единичных концентрациях ионов металлов равна 1.56 В, использовав в качестве анода цинк. Как изменится значение ЭДС, если концентрация ионов Zn+2 у анода увеличится до 10.0 моль/л? (Объемы электролитов у анода и катода равны). Написать электродные процессы.
6. При электролизе водного раствора хлорида магния (MgCl2) на неактивном аноде выделилось 2240 мл газа. Какое это вещество? Какой продукт, и в каком количестве выделился на катоде?
БИЛЕТ № 18
1. Какая из перечисленных солей подвергается гидролизу: SnCl2, Са(NO3)2, NaCl? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации основания равна Кb2 = 1.26·10-12.
2. Равновесие реакции Н2 +I2 = 2HI установилось при следующих концентрациях: [H2]=0.5моль/л; [I2]=0.1моль/л; [HI]=1.8моль/л. Определите константу химического равновесия и исходные концентрации иода и водорода. В начальный момент времени [HI]=0.
3.
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии хромированного медного изделия при нарушении покрытия, если его поместить в сильно разбавленный раствор кислоты (HCl)?
5. Составить гальванический элемент с магниевым и свинцовым электродами. Вычислить ЭДС, если концентрации ионов Men+ у анода и у катода соответственно равны: 0.001 моль/л и 0.1 моль/л. Написать электродные процессы.
6. Металлическое изделие необходимо электрохимическим способом покрыть медью. Предложить схему процесса. Какое количество электричества (в числах Фарадея) надо пропустить через раствор электролита, чтобы получился слой меди массой 1.28 г?
БИЛЕТ № 19
1. Какая из перечисленных солей подвергается гидролизу: МgCl2, Ca(NO3)2, Na2SO4, Na2HPO4. Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка2 = 6.2·10-8.
2. Обратимая реакция протекает по уравнению: А + В Û С + Д. Исходная концентрация каждого из веществ в смеси составляла 1,0 моль/л. После установления равновесия концентрация вещества С стала равна 1,5 моль/л. Вычислите константу равновесия.
3. Описать переход 1® 2
| 1 |
| 2 |
1. Какие коррозионные процессы протекают в случае, если изделие, детали которого изготовлены из никеля и скреплены железными болтами, находится в сильно разбавленном растворе соляной кислоты (рН<7)?
2. Составить схему гальванического элемента, используя в качестве электродов медь и магний. Рассчитать ЭДС элемента в стандартных условиях и при уменьшении концентрации ионов Men+ у катода до 0.001 моль/л. Написать электродные процессы.
3. Какое количество электричества (в числах Фарадея) необходимо пропустить через водный раствор, содержащий 0.5 моль соли Bi(NO3)3, чтобы полностью осадить висмут ? Какое вещество, и в каком количестве выделится на другом электроде? Электроды инертные.
БИЛЕТ № 20
1. Какая из перечисленных солей подвергается гидролизу: K3PO4, NaCl, KNO3? Рассчитать рН раствора, если концентрация этой соли равна 0.1 моль/л, а константа диссоциации кислоты равна Ка3 = 4.6·10-13.
2. В какую сторону сместится равновесие реакции N2O4 Û 2NO2 при понижении температуры (DrH >0).
3.
| 1 |
| 2 |
4. Какие процессы протекают при электрохимической коррозии изделия из цинка при наличии на нем тонкой пленки воды и неравномерной аэрации?
5. Составить гальванический элемент, используя в качестве анода магниевый электрод. Вычислить ЭДС в стандартных условиях, и ее величину при уменьшении концентрации ионов Men+ у катода до 0.01 моль/л. Написать электродные процессы.
6. Предложить схему процесса нанесения на металлический лист размером 20х5 см электрохимическим путем с обеих сторон слой никеля толщиной 2,64 мм (rNi=8,9г/см3). Рассчитать необходимую величину количество электричества (в числах Фарадея). Использовать в качестве электролита водный раствор нитрат никеля (Ni(NO3)2)?
Дата добавления: 2018-11-24; просмотров: 1209; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
