Получение кислорода и азота из воздуха
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):


Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).

Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:

Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
|
|
|
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.

При этом протекает следующая химическая реакция:

Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
|
|
|

Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.

Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
|
|
|
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
|
|
|

Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:

В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).

При этом протекает химическая реакция:

Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).

Протекающую химическую реакцию можно представить следующим уравнением:

Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).

При этом протекает следующая химическая реакция:

В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
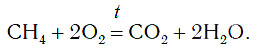
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Дата добавления: 2022-01-22; просмотров: 51; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
