Механизм растворения веществ с ионной и ковалентной полярной связью (для ознакомления)
Лекция по теме
(выучить, подготовиться к зачету Срок сдачи – среда 08.04.2020 г.)
Растворение. Растворимость. Растворы.
Электролитическая диссоциация.
Основные положения Теории электролитической диссоциации»
1. Растворами называют однородные смеси, состоящие из двух или более однородных частей. Это представление исходило из физической теории растворов.
2. Сторонники физической теории растворов, которую развивали Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии, т. е. проникновения растворённого вещества в промежутки между молекулами воды.
3. В противоположность представлениям физической теории растворов Д. И. Менделеев и сторонники химической теории растворов доказывали, что растворение является результатом химического взаимодействия растворённого вещества с молекулами воды. Поэтому правильнее (точнее) определять раствор как однородную систему, состоящую из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
4. Растворение – физико – химический процесс.
5. Растворимость веществ зависит от температуры и от природы вещества
6. Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.
7. Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
|
|
|
8. Пересыщенным называют такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
9. Вещества, растворы или расплавы которых проводят электрический ток, называют электролитами. К ним относятся основания, соли, кислоты с ионной или сильно полярной ковалентной связью.
10. Вещества, растворы или расплавы которых не проводят электрический ток, называют неэлектролитами. К ним относятся: оксиды, простые вещества (металлы и неметаллы), твердые вещества, нерастворимые вещества, органические вещества с малополярной ковалентной связью.
11. Процесс распада электролита на ионы называют электролитической диссоциацией.
12. Электролитическая диссоциация – обратимый процесс.
Слева направо – диссоциация, справа налево – ассоциация.
13. Степень диссоциации — это отношение количества вещества электролита, распавшегося на ионы (nд), к общему количеству растворенного вещества(nр):

14. По степени диссоциации все электролиты подразделяются на сильные и слабые электролиты.
15. Сильные электролиты – это электролиты, которые даже при больших концентрациях и малых разбавлениях хорошо проводят электрический ток. К ним относятся: Кислоты – серная, азотная, хлороводородная, бромоводородная, иодоводородная. Щелочи. Растворимые соли.
|
|
|
16. Слабые электролиты – это электролиты, которые даже при малых концентрациях и больших разбавлениях плохо проводят электрический ток.
17. Основные положения Теории электролитической диссоциации.(ТЭД)
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
2. Причиной диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду, поэтому их называют анионами.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
|
|
|
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
7. Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка:

8. Основаниями называют электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы ОН-:

9. Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония  ) и анионы кислотных остатков:
) и анионы кислотных остатков:

Механизм растворения веществ с ионной и ковалентной полярной связью (для ознакомления)
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.

Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решёткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита (рис. 130).
|
|
|
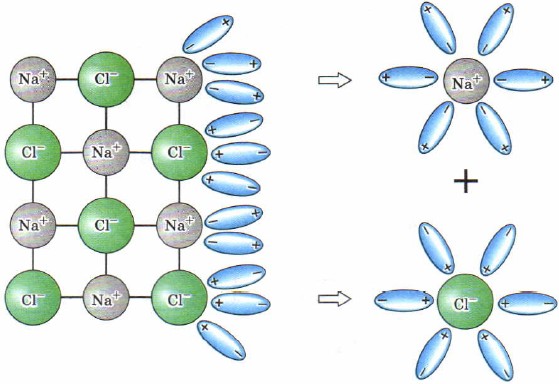
Рис. 130.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
- ориентация молекул — диполей воды около ионов кристалла;
- гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
- диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощённо происходящие процессы можно отразить с помощью следующего уравнения:
NaCl = Na+ + Cl-.
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, молекулы хлороводорода НСl, рис. 131), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную, и последовательность процессов, происходящих при этом, будет такая:
- ориентация молекул воды вокруг полюсов молекулы электролита;
- гидратация (взаимодействие) молекул воды с молекулами электролита;
- ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
- диссоциация (распад) молекул электролита на гидратированные ионы.

Рис. 131.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Уравнение диссоциации соляной кислоты:
НСl = Н+ + Cl-.
В растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и объединиться. Этот обратный процесс называют ассоциацией.
Свойства гидратированных и негидратированных ионов различаются. Например, негидратированный ион меди Сu2+ — бесцветный в безводных кристаллах сульфата меди (II) CuSO4 и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Сu2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Дата добавления: 2021-07-19; просмотров: 1797; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
